- Dihidrógeno
-
Dihidrógeno
Nombre (IUPAC) sistemático Hidrógeno General Fórmula semidesarrollada H2 Fórmula molecular n/d Identificadores Número CAS 1333-74-0 Propiedades físicas Estado de agregación Gas Masa molar 2,01589(4) g/mol Propiedades químicas Termoquímica S0gas, 1 bar 130.680 ± 0.003 J·mol-1·K-1 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl dihidrógeno[1] es una molécula diatómica homonuclear compuesta por dos átomos de hidrógeno; a temperatura ambiente es un gas inflamable, incoloro e inodoro.
En laboratorio se obtiene mediante la reacción de ácidos con metales como el zinc e industrialmente mediante la electrólisis del agua. El hidrógeno se emplea en la producción de amoníaco, como combustible alternativo y recientemente para el suministro de energía en las pilas de combustible.
Tiene un punto de ebullición de tan sólo 20,27 K (-252,88 °C) y un punto de fusión de 14,02 K (-259,13 °C). A muy alta presión, tal como la que se produce en el núcleo de las estrellas gigantes de gas, las moléculas mudan su naturaleza y el hidrógeno se convierte en un líquido metálico (ver hidrógeno metálico). A muy baja presión, como la del espacio, el hidrógeno tiende a existir en átomos individuales, simplemente porque es muy baja la probabilidad de que se combinen, sin embargo, cuando esto sucede pueden llegar a formarse nubes de H2 que se asocian a la génesis de las estrellas.
Contenido
Aplicaciones
En la industria química y petroquímica se requieren grandes cantidades de H2. La aplicación principal del H2 es para el procesamiento (refinado) de combustibles fósiles, y en la síntesis de amoníaco (proceso de Haber). Los procesos fundamentales que consumen H2 en una planta petroquímica son la hidrodesalquilación, la hidrodesulfurización y el hidrocraking.[2] El H2 posee otros muchos usos como agente hidrogenante, particularmente en el incremento de la saturación de grasas y aceites insaturados (que se encuentran en productos como la margarina), y en la producción de metanol. Es empleado también en la manufactura del ácido clorhídrico, y como agente reductor para minerales metálicos.
- Producción de ácido clorhídrico, combustible para cohetes, y reducción de minerales metálicos.
- El hidrógeno líquido se emplea en aplicaciones criogénicas, incluyendo la investigación de la superconductividad.
- Empleado antaño por su ligereza como gas de relleno en globos y zepelines, tras el desastre del Hindenburg se abandonó su uso por su gran inflamabilidad.
Aparte de sus usos como reactivo, el H2 posee muchas aplicaciones en Física e Ingeniería. Se usa para el escudo de gas en métodos de soldadura tales como la soldadura de hidrógeno atómico. El H2 se emplea como refrigerante en generadores eléctricos en las estaciones eléctricas, ya que es el gas con mayor conductividad térmica. El H2 líquido se usa en la investigación criogénica, incluyendo el estudio de la superconductividad. Puesto que el H2 es más ligero que el aire (posee una densidad poco mayor a la quinceava parte de la del aire) fue usado como gas de relleno para globos aerostáticos y aeronaves. Sin embargo, este uso fue abandonado tras el desastre del Hindenburg que evidenció la peligrosidad del hidrógeno cuando es usado para estos fines. No obstante, aún se sigue usando para inflar globos sonda meteorológicos.
Los isótopos del hidrógeno también tienen sus aplicaciones particulares. El deuterio (2H) posee aplicaciones en el campo de la fisión nuclear, como moderador para frenar neutrones, y también tiene aplicaciones en reacciones de fusión nuclear. Los compuestos de deuterio tienen usos en Química y Biología, sobre todo en los estudios de efectos isotópicos. El tritio (3H), generado en los reactores nucleares, se usa en la producción de bombas de hidrógeno, como radiomarcador en Ciencias Biológicas, y como fuente de radiación en pinturas luminiscentes.
La temperatura de equilibrio del punto triple del hidrógeno es un punto fijo definido en la escala de temperaturas ITS-90.
El spin o giro de la molécula de hidrógeno puede ser alineado homogéneamente mediante ondas de radiofrecuencia. Esta propiedad es el fundamento de la resonancia magnética nuclear, dispositivo de obtención de imágenes que es capaz de recoger información en función de la diferente velocidad de recuperación del spin original de las moléculas de hidrógeno (presentes en el agua) de los diferentes tejidos de un ser vivo.
El hidrógeno como portador de energía
El hidrógeno no es una fuente de energía, excepto en el hipotético contexto de las plantas comerciales de fusión nuclear alimentadas por deuterio o tritio, una tecnología que actualmente se encuentra en desarrollo en el reactor experimental ITER. La energía del Sol proviene de la fusión nuclear del hidrógeno, sin embargo, es un proceso complicado de conseguir en la Tierra. El hidrógeno elemental obtenido de fuentes solares, biológicas o eléctricas cuesta mucha más energía para producirlo de la que se obtiene de su combustión. El hidrógeno puede generarse a partir de fuentes fósiles (como el metano) gastando menos energía de la que se obtiene, pero se trata de fuentes no renovables que, además son fuentes energéticas por sí mismas.
Hidrógeno como combustible
Se ha hablado mucho del hidrógeno molecular como posible portador de energía. El uso del H2 tendría la ventaja de que las fuentes fósiles podrían usarse directamente para la obtención del gas (a partir de metano, por ejemplo). El H2 usado en los medios de transporte produciría una combustión limpia en la que el único producto sería el agua, eliminando por completo las emisiones de CO2.
Sin embargo, los costes para la infraestructura necesaria para llevar a cabo un conversión completa a una economía del hidrógeno serían sustanciales.[3] Además, la densidad energética del hidrógeno líquido o gaseoso (dentro de unas presiones prácticas) es significativamente menor que los combustibles tradicionales.
Por ejemplo, puede emplearse en motores de combustión interna. Una flota de automóviles con motores de este tipo es mantenida en la actualidad por Chrysler-BMW. Además, las pilas de combustible en desarrollo parece que serán capaces de ofrecer una alternativa limpia y económica a los motores de combustión interna.
Véase también: Energías renovables en AlemaniaDebido a que el hidrógeno es escaso en forma libre y la mayor parte de él se encuentra combinado con otros elementos, no es una fuente de energía primaria, como sí lo son el gas natural, el petróleo y el carbón. En realidad el hidrógeno es un vector energético, es decir un portador de energía que se debe producir a partir de fuentes primarias. Aun así el hidrógeno como combustible presenta diversas ventajas. El hidrógeno se quema en el aire libre cuando hay concentraciones entre el 4 y 75% de su volumen, en cambio el gas natural lo hace entre 5,4 y 15%. La temperatura por combustión espontánea es de 585 °C, mientras que para el gas natural es de 540 °C. El gas natural explota en concentraciones de 6.3 a 14%, mientras que el hidrógeno requiere concentraciones entre el 13 y el 64%, por lo que el gas natural es más explosivo que el hidrógeno.
En la actualidad existen cuatro formas de utilizar el hidrógeno para producir energía:
- Uniendo sus núcleos dentro de un reactor denominado Tokamak, durante el proceso conocido como fusión nuclear.
- Combinándolo electroquímicamente con el oxígeno sin generar flama para producir directamente electricidad dentro de un reactor conocido como celda de combustible.
- Combinándolo químicamente con el oxígeno del aire a través de quemadores convencionales y a través de procesos catalíticos, teniendo este método una amplia aplicación doméstica.
- Combinándolo químicamente con el oxígeno en medio acuoso dentro de una caldera no convencional para producir vapor motriz, en el ciclo conocido como Chan K'iin [1].
Uno de los principales problemas que se tienen con el hidrógeno es su almacenamiento y transporte. Si se confina en forma gaseosa, el contenedor tendría que soportar presiones de hasta 200 atmósferas. Si se desea almacenar en forma líquida, se tiene que enfriar a -253 °C y posteriormente guardarse en un depósito perfectamente aislado. Otra forma de almacenamiento se puede llevar a cabo mediante una reacción química reversible con diversas sustancias formando hidruros metálicos.
Propiedades físicas y químicas
Las características de solubilidad y de adsorción del hidrógeno con varios metales son muy importantes en la metalurgia (algunos metales pueden sufrir debilitamiento por hidrógeno) y en el desarrollo de formas seguras de almacenamiento para su uso como combustible. El hidrógeno es muy soluble en muchos compuestos formados por metales de las tierras raras y metales de transición,[4] y puede disolverse tanto en metales cristalinos como en metales amorfos.[5] La solubilidad del hidrógeno en los metales esta influenciada por las distorsiones locales y las impurezas de la red cristalina del metal.[6]
Combustión
El hidrógeno gaseoso es muy inflamable y arde en concentraciones muy bajas en aire (4% de H2). La entalpía de combustión del hidrógeno es – 286 kJ/mol, y la reacción de combustión es la siguiente:
- 2 H2(g) + O2(g) → 2 H2O(l) + 572 kJ/mol
Cuando se mezcla con oxígeno en un amplio rango de proporciones el hidrógeno explota. En el aire, el hidrógeno arde violentamente. Las llamas de oxígeno e hidrógeno puro son casi invisibles al ojo humano, como se constata al ver lo tenues que son las llamas de los motores principales de las lanzaderas espaciales (en contraposición a lo fácilmente visibles que son las llamas de los cohetes impulsores de las lanzaderas). Por este motivo, es difícil detectar visualmente si un escape de hidrógeno está ardiendo. Las llamas que se aprecian en las fotos del dirigible Hindenburg son llamas de hidrógeno coloreadas por el material de la cubierta de la aeronave, que contenía carbono y polvo de aluminio pirofórico, así como otros materiales combustibles.[7] (Independientemente de la causa de este incendio, es claro que se produjo la ignición del hidrógeno, ya que en ausencia de este gas la cubierta del dirigible habría tardado horas en quemarse).[8] Otra característica de los fuegos alimentados por hidrógeno es que las llamas tienden a ascender rápidamente con el gas a través del aire (algo que también se puede apreciar en las fotografías del accidente del Hindeburg), causando menos daños que los fuegos alimentados por hidrocarburos. Por ejemplo, dos tercios de los pasajeros del dirigible sobrevivieron al incendio, y muchas de las muertes que se produjeron fueron por caídas al vacío y por la combustión de gasolina.[9]
El H2 reacciona directamente con otros elementos oxidantes. Puede producirse una reacción espontánea y violenta a temperatura ambiente en presencia de cloro o flúor, con la formación de los correspondientes halogenuros de hidrógeno: cloruro de hidrógeno y fluoruro de hidrógeno.
Historia
Descubrimiento del H2
El hidrógeno diatómico gaseoso, H2, fue formalmente descrito por primera vez por T. Von Hohenheim (más conocido como Paracelso, 1493 - 1541) que lo obtuvo artificialmente mezclando metales con ácidos fuertes. Paracelso no era consciente de que el gas inflamable generado en estas reacciones químicas estaba compuesto por un nuevo elemento químico. En 1671, Robert Boyle redescubrió y describió la reacción que se producía entre limaduras de hierro y ácidos diluidos, y que generaba hidrógeno gaseoso.[10]
En 1766, Henry Cavendish fue el primero en reconocer el hidrógeno gaseoso como una sustancia discreta, identificando el gas producido en la reacción metal - ácido como "aire inflamable" y descubriendo que la combustión del gas generaba agua. Cavendish tropezó con el hidrógeno cuando experimentaba con ácidos y mercurio. Aunque asumió erróneamente que el hidrógeno era un componente liberado por el mercurio y no por el ácido, fue capaz de describir con precisión varias propiedades fundamentales del hidrógeno. Tradicionalmente, se considera a Cavendish el descubridor de este elemento.
En 1783, Antoine Lavoisier dio al elemento el nombre de hidrógeno (en francés Hydrogène, del griego ὕδωρ, ὕδᾰτος, "agua" y γένος-ου, "generador") cuando comprobó (junto a Laplace) el descubrimiento de Cavendish de que la combustión del gas generaba agua.
Primeros usos
Uno de los primeros usos que se dio al hidrógeno gaseoso fue como gas de relleno para globos aerostáticos y, más tarde, otras aeronaves. El hidrógeno gaseoso se obtenía por reacción entre el ácido sulfúrico y el hierro metálico. La alta y rápida inflamabilidad del hidrógeno gaseoso se dejó patente en la tragedia del dirigible Hindenburg en 1937, que se incendió cuando aterrizaba provocando la muerte de 35 personas. Debido a esta peligrosidad que presentaba el hidrógeno gaseoso, fue reemplazado posteriormente en globos y aeronaves por el helio gaseoso, un gas inerte.
 El hidrógeno puede inflamarse rápidamente en el aire. Esto es lo que sucedió en el desastre del Hindenburg, el 6 de mayo de 1937.
El hidrógeno puede inflamarse rápidamente en el aire. Esto es lo que sucedió en el desastre del Hindenburg, el 6 de mayo de 1937.
Obtención y producción
El H2 se obtiene en laboratorios de Química y de Biología, a menudo como subproducto de otras reacciones; en la industria se obtiene para la hidrogenación de sustratos insaturados; y en la naturaleza como medio para expeler equivalentes reductores en las reacciones bioquímicas.
Síntesis en laboratorio
En el laboratorio, el H2 suele obtenerse por la reacción de ácidos con metales, tales como el zinc.
- Zn + 2 H+ → Zn2+ + H2
En el caso del aluminio, no sólo se genera H2 cuando es tratado con un ácido, sino que también lo hace cuando se le trata con una base:
- 2 Al + 6 H2O → 2 Al(OH)3 + 3 H2
La electrolisis del agua es un método simple de producir hidrógeno, aunque el gas resultante posee necesariamente menos energía de la requerida para producirlo. Una corriente de bajo voltaje atraviesa el agua, formándose oxígeno gaseoso en el ánodo e hidrógeno gaseoso en el cátodo. Generalmente, cuando se produce hidrógeno que va a ser almacenado se emplea un cátodo de platino o de algún otro metal inerte. Por el contrario, si el hidrógeno va a ser consumido in situ, es necesaria la presencia de oxígeno para que se produzca la combustión y se procura que ambos electrodos (tanto ánodo como cátodo) sean de metal inerte (si se empleara un metal no inerte, por ejemplo el hierro, éste se oxidaría y disminuiría la cantidad de oxígeno que se desprende). La máxima eficiencia teórica (electricidad empleada frente al valor energético del hidrógeno generado) es de entre un 80% y un 94%.[11]
- 2H2O(aq) → 2H2(g) + O2(g)
En el año 2007 se descubrió que una aleación de aluminio y galio en forma de pastilla añadida al agua puede emplearse para obtener hidrógeno.[12] El proceso también produce óxido de aluminio(III), pero el galio (que posee un elevado precio), que previene la formación de una capa de óxido en la superficie de la pastilla, puede reutilizarse. Este descubrimiento tiene importantes implicaciones en la economía del hidrógeno, ya que éste puede sintetizarse in situ fácilmente y no necesita ser transportado.
Síntesis industrial
El hidrógeno puede obtenerse de distintas maneras, pero las más económicas implican su extracción a partir de hidrocarburos. El hidrógeno comercial se produce generalmente mediante el reformado con vapor del gas natural.[13] Este proceso consiste en la reacción de una corriente de vapor de agua con metano para originar monóxido de carbono e hidrógeno, a una temperatura de entre 700 °C y 1100 °C.
- CH4 + H2O → CO + 3 H2
Esta reacción está favorecida a bajas presiones, sin embargo, se lleva a cabo a altas presiones (20 atm) ya que el H2 de alta presión es el producto más comercializable. La mezcla producto se conoce como "gas de síntesis" porque a menudo se usa directamente para la producción de metanol y otros compuestos relacionados. A parte del metano, pueden usarse otros hidrocarburos para generar el gas de síntesis con distintas proporciones de los componentes productos. Una de las complicaciones que se presenta en esta tecnología altamente optimizada es la formación de coque o carbón:
- CH4 → C + 2 H2
Para evitarlo, el reformado con vapor suele emplear un exceso de H2O.
Puede recuperarse hidrógeno adicional en este proceso a partir del monóxido de carbono, mediante una reacción de desplazamiento del agua gaseosa, especialmente con un catalizador de óxido de hierro. Esta reacción también se emplea industrialmente como fuente de dióxido de carbono:[13]
- CO + H2O → CO2 + H2
Otros métodos importantes para la producción de H2 incluyen la oxidación parcial de hidrocarburos:
- CH4 + 0.5 O2 → CO + 2 H2
y la reacción del carbón, que puede servir como preludio a la reacción de desplazamiento mencionada anteriormente:[13]
- C + H2O → CO + H2
Muchas veces el hidrógeno es producido y consumido en el mismo proceso industrial, sin necesidad de ser separado. En el proceso Haber - Bosch para la síntesis de amoníaco (el quinto compuesto más producido industrialmente en el mundo), el hidrógeno se obtiene a partir del gas natural.
El hidrógeno también se produce en cantidades significativas como un subproducto en la mayoría de los procesos petroquímicos de cracking con vapor y reformado. La electrólisis de la salmuera para obtener cloro también genera hidrógeno como subproducto.
Síntesis biológica
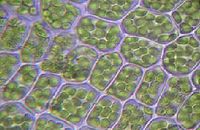 Micrografía mostrando los cloroplastos en un tejido vegetal. Las hidrogenasas presentes en estos orgánulos son capaces de generar H2 gaseoso.
Micrografía mostrando los cloroplastos en un tejido vegetal. Las hidrogenasas presentes en estos orgánulos son capaces de generar H2 gaseoso.
El hidrógeno es un producto de algunos tipos de metabolismo anaeróbico y es generado por muchos microorganismos, generalmente a través de reacciones catalizadas por enzimas que contienen hierro o níquel, llamadas hidrogenasas. Estas enzimas catalizan la reacción redox reversible entre el H2 y sus dos protones y dos electrones. La evolución del hidrógeno gaseoso tiene lugar en la transferencia de equivalentes reductores (producidos durante el metabolismo del piruvato) al agua.[14]
La separación del agua, en la que ésta se descompone en sus protones, electrones y oxígeno, tiene lugar en las reacciones de la fase luminosa del metabolismo de los organismos fotosintéticos. Algunos de esos organismos -incluyendo el alga Chlamydomonas reinhardtii y las cianobacterias- han evolucionado desarrollando un segundo paso en las reacciones de las fase oscura en el que los protones se reducen para formar H2 gaseoso por la acción de hidrogenasas especializadas en los cloroplastos.[15] Se han realizado esfuerzos para modificar genéticamente las hidrogenasas bacterianas para sintetizar H2 gaseoso de manera eficiente incluso en presencia de oxígeno.[16]
Existen otras rutas poco frecuentes, aunque mecanísticamente interesantes, para la producción de H2 en la naturaleza. La nitrogenasa genera aproximadamente un equivalente de H2 por cada equivalente de N2 reducido a amoníaco. Algunas fosfatasas reducen fosfitos a H2.
Formas
En condiciones normales, el gas hidrógeno es una mezcla de dos tipos de hidrógeno diferentes en función de la dirección del espín de sus electrones y núcleos. Estas formas se conocen como orto- y para-hidrógeno. El hidrógeno normal está compuesto por un 25% de la forma para- y un 75% de la forma orto-, la considerada "normal", aunque no pueda obtenerse en estado puro. Ambas formas tienen energías ligeramente diferentes, lo que provoca que sus propiedades físicas no sean idénticas; así por ejemplo, la forma para- tiene puntos de fusión y ebullicicón 0,1 K más bajos que la forma orto-.
Precauciones
El hidrógeno es un gas extremadamente inflamable. Reacciona violentamente con el flúor y el cloro, especialmente con el primero, con el que la reacción es tan rápida e imprevisible que no se puede controlar. También es peligrosa su despresurización rápida, ya que a diferencia del resto de gases, al expandirse por encima de -40 °C se calienta, pudiendo inflamarse.
ESPECIFICACIONES TÉCNICAS DEL HIDRÓGENO
- ICSC: 0001
- CAS:
- UN:1049
- CE:001-001-00-9
- Punto de ebullición: - 252,8 °C
- Muy poco miscible en agua
- Temperatura de autoignición 580 °C
- Punto de congelación: - 252,9 °C
- Temperatura crítica: - 240,9 °C
Peligros
Físicos
El gas es más ligero que el aire. El gas se mezcla bien con el aire, formándose fácilmente mezclas explosivas.
Químicos
El calentamiento intenso puede originar combustión violenta o explosión. Reacciona violentamente con aire, oxígeno, cloro, flúor y oxidantes fuertes originando peligro de incendio y explosión. Los metales catalizadores tales como el platino o el níquel aumentan este tipo de reacciones.
Incendios
Evitar las llamas, no producir chispas y no fumar. Extremadamente inflamable. Su rango de inflamabilidad es muy grande. Muchas reacciones pueden producir incendio o explosión. Si es posible, cortar el suministro. Si se puede y no existe riesgo para el entorno próximo, dejar que el fuego se extinga por sí mismo. Apagar con agua pulverizada, polvo, dióxido de carbono y halón. El hidrógeno cuando se produce fuego o explosión se quema con una llama casi invisible.
Explosión
Las mezclas gas/aire son explosivas. Como prevención se debe tener la ventilación adecuada. Las herramientas manuales no deben generar chispas. Los equipos eléctricos y de alumbrado deben estar preparados a prueba de explosión. El incendio debe de combatirse desde un lugar protegido.
Derrames y fugas
Para comprobar si existen escapes, utilizar agua y jabón. Evacuar la zona de peligro. Ventilar las áreas cerradas para prevenir la formación de atmósferas inflamables o deficientes de oxígeno. La ventilación puede ser manual o mecánica. Eliminar todas las fuentes potenciales de ignición. Para ayuda adicional, consultar a un experto. Llevar equipo autónomo de respiración.
Exposición
El hidrógeno no es tóxico y está clasificado como un simple asfixiante. La cantidad necesaria para reducir las concentraciones del oxígeno en un nivel inferior al requerido para soportar la vida causaría mezclas dentro de los rangos de inflamabilidad. Por tanto, se prohíbe la entrada en áreas que contengan mezclas inflamables debido al peligro inmediato de incendio o explosión. El hidrógeno se puede absorber por inhalación y a través de la piel.
Al ocasionarse pérdidas en zonas confinadas, este líquido se evapora muy rápidamente originando una saturación total del aire, pudiendo producir asfixia, dificultad respiratoria, y pérdida de conocimiento. Como prevención se debe tener la ventilación adecuada introduciendo aire limpio.
En contacto con líquido se produce la congelación. Como prevención se debe de utilizar guantes aislantes del frío y traje de protección.
Almacenamiento
Almacenar los cilindros y contenedores en áreas bien ventiladas. Mantenga los cilindros alejados de las fuentes de ignición y de material combustible. Se evitará ponerlos en áreas en las que haya sales y otros productos químicos corrosivos. El almacenamiento del hidrógeno debe de estar separado de los gases oxidantes, tales como oxígeno, flúor, etc. al menos a 6 metros de distancia.
Hidrogeneras
Las hidrogeneras son las estaciones de servicio preparadas para servir hidrógeno en los coches de pila de combustible.
Referencias
- ↑ Connelly, Neil G. (2005). «Nomenclature of inorganic chemistry - IUPAC recommendations». Nomenclature of Inorganic Chemistry. p. 49, ISBN 0-85404-438-8. http://books.google.com/books?id=w1Kf1CakyZIC&pg=PA49&lpg=PA49&dq=IR-3.4.3+Names+of+allotropes+of+definite+molecular+formula&source=web&ots=rMxMYCRX0d&sig=Tf0aQ10Re2ZdhQo807qAJNFGycE.
- ↑ «Los Alamos National Laboratory – Hydrogen». Consultado el 15 de septiembre de 2005.
- ↑ See Romm, Joseph (2004). The Hype about Hydrogen, Fact and Fiction in the Race to Save the Climate. New York: Island Press. (ISBN 1-55963-704-8)
- ↑ Takeshita T, Wallace WE, Craig RS. (1974). Hydrogen solubility in 1:5 compounds between yttrium or thorium and nickel or cobalt. Inorg Chem 13(9):2282.
- ↑ Kirchheim R, Mutschele T, Kieninger W. (1988). Hydrogen in amorphous and nanocrystalline metals Mater. Sci. Eng. 99: 457–462.
- ↑ Kirchheim R. (1988). Hydrogen solubility and diffusivity in defective and amorphous metals. Prog. Mater. Sci. 32(4):262–325.
- ↑ Bain A; Van Vorst WD (1999). «The Hindenburg tragedy revisited: the fatal flaw exposed». International Journal of Hydrogen Energy 24 (5): pp. 399–403.
- ↑ Dziadecki, John (2005). «Hindenburg Hydrogen Fire». Consultado el 16-01-2007.
- ↑ «The Hindenburg Disaster». Swiss Hydrogen Association. Consultado el 16-01-2007.
- ↑ «Webelements – Hydrogen historical information». Consultado el 15 de septiembre de 2005.
- ↑ http://bellona.org/filearchive/fil_Hydrogen_6-2002.pdf Informe de la empresa Bellona sobre el hidrógeno.
- ↑ «New process generates hydrogen from aluminum alloy to run engines, fuel cells».
- ↑ a b c Oxtoby DW, Gillis HP, Nachtrieb NH. (2002). Principles of Modern Chemistry 5th ed. Thomson Brooks/Cole
- ↑ Cammack, R.; Frey, M.; Robson, R. Hydrogen as a Fuel: Learning from Nature; Taylor & Francis: London, 2001
- ↑ Kruse O, Rupprecht J, Bader KP, Thomas-Hall S, Schenk PM, Finazzi G, Hankamer B. (2005). Improved photobiological H2 production in engineered green algal cells. J Biol Chem 280(40):34170–7.
- ↑ United States Department of Energy FY2005 Progress Report. IV.E.6 Hydrogen from Water in a Novel Recombinant Oxygen-Tolerant Cyanobacteria System. HO Smith, Xu Q. http://www.hydrogen.energy.gov/pdfs/progress05/iv_e_6_smith.pdf Visitado el 16 de agosto de 2006.
Véase también
 Wikimedia Commons alberga contenido multimedia sobre DihidrógenoCommons.
Wikimedia Commons alberga contenido multimedia sobre DihidrógenoCommons.- Hidrógeno (elemento)
- Economía del hidrógeno
- Vehículo de hidrógeno
- Pila de combustible
- Tecnologías de hidrógeno
Enlaces externos
 Wikcionario tiene definiciones para hidrógeno.Wikcionario
Wikcionario tiene definiciones para hidrógeno.Wikcionario
Wikimedia foundation. 2010.


