- Ácido nítrico
-
Ácido nítrico
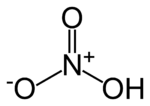
Nombre (IUPAC) sistemático Ácido trioxonítrico (V) General Otros nombres Trioxonitrato (V) de hidrógeno
Ácido de grabadores
Aqua fortis
Ácido azóico
Nitrato de Hidrógeno
Espíritu de Nitro
Ácido de Salitre
Scheidewasser
Ácido azótico
Espíritu de Salitre
Ácido de nitroFórmula semidesarrollada HNO3 Fórmula estructural Véase imagen arriba Fórmula molecular HNO3 Identificadores Número CAS 7697-37-2 PubChem Número RTECS QU5775000 Propiedades físicas Estado de agregación Líquido Apariencia Límpido - transparente (si es puro) o amarillento (si posee residuos de la síntesis industrial) Densidad 1500 kg/m3; 1,5 g/cm3 Masa molar 63.012 g/mol Punto de fusión 231 K (-42 °C) Punto de ebullición 356 K (83 °C) Propiedades químicas Solubilidad en agua Miscible en cualquier proporción Momento dipolar 2,17 D Termoquímica S0gas, 1 bar 266,39 J·mol-1·K-1 S0líquido, 1 bar 156 J·mol-1·K-1 Peligrosidad NFPA 704 Frases R R8, R35 Frases S S23, S26, S36, S45 Número RTECS QU5775000 Riesgos Ingestión Corrosivo. Dolor abdominal, sensación de quemazón, shock. Inhalación Corrosión del tracto respiratorio, tos, dificultad respiratoria, pérdida del conocimiento. Piel Puede causar graves quemaduras. Ojos Quemaduras graves e irritación ocular. Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl compuesto químico ácido nítrico es un líquido corrosivo y tóxico que puede ocasionar graves quemaduras.
Es utilizado comúnmente como un reactivo de laboratorio, se utiliza para fabricar explosivos como la nitroglicerina y trinitrotolueno (TNT), así como fertilizantes como el nitrato de amonio. Tiene usos adicionales en metalurgia y en refinado, ya que reacciona con la mayoría de los metales y en la síntesis química. Cuando se mezcla con el ácido clorhídrico forma el agua regia, un raro reactivo capaz de disolver el oro y el platino. El ácido nítrico también es un componente de la lluvia ácida.
Contenido
Síntesis
El ácido nítrico se obtiene mezclando pentóxido de dinitrógeno (N2O5) y agua. Sintetizar ácido nítrico puro impone habitualmente la destilación con ácido sulfúrico, ya que el ácido nítrico forma un azeótropo con el agua en una composición del 68% de ácido nítrico y 32% de agua. Las soluciones comerciales incluyen entre un 52% y un 68% de ácido nítrico. Si la solución incluye más de un 86% de ácido nítrico se nombra como ácido nítrico fumante y viene en dos variedades, blanco y rojo. El ácido nítrico blanco fumante también se llama 100% ya que no tiene casi agua (menos de un 1%) según el proceso.
A nivel industrial, se fabrica mediante la síntesis del amoniaco y oxigeno. Ambos elementos se combinan en un reactor de grandes proporciones ante la presencia de un catalizador metálico. Debido a las altas temperaturas que se soportan (700-900 grados centígrados), se utilizan metales que guarden sus características físicas a estas temperaturas, siendo el más apropiado el platino, en combinación con rodio (5-10%) que le aporta más rigidez.
Propiedades
Propiedades físicas
El ácido nítrico puro es un líquido viscoso, incoloro e inodoro. A menudo, distintas impurezas lo colorean de amarillo-marrón. A temperatura ambiente libera humos rojos o amarillos. El ácido nítrico concentrado tiñe la piel humana de amarillo al contacto, debido a una reacción con la Cisteina presente en la queratina de la piel.
Punto de ebullición: 121ºC Punto de fusión: -41,6ºC Densidad relativa (agua = 1): 1,4 Solubilidad en agua: Miscible Presión de vapor, kPa a 20ºC: 6,4 Densidad relativa de vapor (aire = 1): 2,2
Propiedades químicas
El ácido nítrico es un agente oxidante potente; sus reacciones con compuestos como los cianuros, carburos, y polvos metálicos pueden ser explosivas. Las reacciones del ácido nítrico con muchos compuestos orgánicos, como de la trementina, son violentas, la mezcla siendo hipergólica (es decir, autoinflamable). Es un fuerte ácido: en solución acuosa se disocia completamente en un ion nitrato NO3- y un protón hídrico. Las sales del ácido nítrico (que contienen el ion nitrato) se llaman nitratos.
Aplicaciones
1· Como agente nitrante en la fabricación de explosivos. 2· En la fabricación de abonos. 3· El ácido nítrico es empleado, en algunos casos, en el proceso de pasivación. 4· El ácido nítrico es utilizado en grabado artístico (aguafuerte), también se usa para comprobar el oro y el platino.
Enlaces externos
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España Ficha internacional de seguridad química del ácido nítrico.
Categorías:- Oxácidos con nitrógeno
- Nitratos
- Productos químicos usados en fotografía
Wikimedia foundation. 2010.

