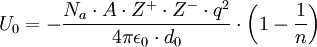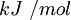- Energía reticular
-
Energía reticular
La energía reticular o energía de red es la energía desprendida al formarse un mol de un compuesto iónico sólido a partir de sus iones en estado gaseoso.
No es posible medir la energía reticular directamente. Sin embargo, si se conoce la estructura y composición de un compuesto iónico, puede calcularse, o estimarse, mediante la ecuación que proporciona el modelo iónico y que se basa entre otras leyes en la Ley de Coulomb.
El modelo iónico, es decir, el que considera al sólido iónico como formado por cationes y aniones unidos por fuerzas electrostáticas, es un caso límite de enlace en sólidos y es válido, solamente, cuando existe una gran diferencia de electronegatividad entre ambos elementos.
En un sólido idealmente iónico, los electrones se encuentran completamente localizados en los iones correspondientes y sujetos sólo a la influencia de sus núcleos respectivos. No existe deslocalización de electrones como en el caso de los sólidos metálicos ni compartición de los mismos como en los sólidos covalentes. Como consecuencia de esta estricta localización de los electrones, los sólidos iónicos no conducen la corriente eléctrica, por lo que son aislantes.
La ecuación que resulta de aplicar dicho modelo resulta ser:
Donde Na es el número de Avogadro, A la constante de Madelung, que varía dependiendo de la estructura del compuesto iónico, Z + la carga del catión y Z − la carga del anión, q la carga del electrón, ε0 la permitividad del vacío, d0 la distancia entre el anión y el catión y n los exponentes de Born.
La energía de red se puede determinar experimentalmente de un modo indirecto aplicando la ley de Hess, que es un caso particular del primer principio de la termodinámica. En este caso se usa el llamado ciclo de Born-Haber que consiste en evaluar un ciclo termodinámico que es el resultado de considerar:- La energía puesta en juego en la formación del compuesto iónico sólido por un camino directo, es decir, a partir de los elementos que forman el compuesto en su estado estándar.
- La energía transferida en la formación de dicho compuesto a partir de sus elementos en estado estándar pero a través de un camino indirecto que comprende varias etapas:
- Proceso de formación de átomos en estado gaseoso a partir de los elementos en su estado estándar. En esta etapa generalmente habrá que tener en cuenta energías asociadas a la sublimación, vaporización o disociación de los elementos que formarán el compuesto iónico, y que dependerá del estado de agregación en el que estos se encuentren.
- Formación de los iones estables, que se encuentran en el retículo iónico, a partir de los elementos en estado gaseoso. Están implicadas la energía de ionización y la afinidad electrónica de dichos elementos.
- Formación de la red cristalina a partir de los iones estables gaseosos. Es una energía desprendida cuando se forma un compuesto iónico a partir de un metal y un no metal.
Unidades
La energía reticular presenta dimensiones de energía/mol y las mismas unidades que la entalpía estándar (ΔHo), pero de signo contrario, es decir:
Véase también
Categorías: Fisicoquímica | Termoquímica | Química del estado sólido
Wikimedia foundation. 2010.