- Energía de ionización
-
Energía de ionización
El potencial de ionización o energía de ionización o EI es la mínima energía que hay que suministrar a un átomo neutro y en su estado fundamental, perteneciente a un elemento en estado gaseoso, para arrancarle un electrón. La reacción puede expresarse de la siguiente forma:
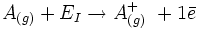
Siendo A(g) los átomos neutros de una sustancia elemental en estado gaseoso; EI, la energía de ionización y
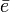 un electrón.
un electrón.Esta energía corresponde a la primera ionización. El segundo potencial de ionización representa la energía precisa para sustraer el segundo electrón; este segundo potencial de ionización es siempre mayor que el primero, pues el volumen de un ion positivo es menor que el del átomo y la fuerza electrostática es mayor en el ion positivo que en el átomo, ya que se conserva la misma carga nuclear.
El potencial o energía de ionización se expresa en electrón-voltio, jules o en kilo Jules por mol (kJ/mol).
1 eV = 1,6 × 10-19 C × 1 V = 1,6 × 10-19 J
En los elementos de una misma familia o grupo el potencial de ionización disminuye a medida que aumenta el número atómico, es decir, de arriba abajo.Sin embargo, el aumento no es continuo, pues en el caso del berilio y el nitrógeno se obtienen valores más altos que lo que podía esperarse por comparación con los otros elementos del mismo período. Este aumento se debe a la estabilidad que presentan las configuraciones s² y s² p³,respectivamente.
La energía de ionización más elevada corresponde a los gases nobles, ya que su configuración electrónica es la más estable, y por tanto habrá que proporcionar más energía para arrancar los electrones.
Potencial de Ionizacion
Potencial de ionización (PI) Es la energía mínima requerida para separar un electrón de un átomo o molécula especifica a una distancia tal que no exista interacción electrostática entre el Ion y el electrón. Inicialmente se definía como el potencial mínimo necesario para que un electrón saliese de un átomo que queda ionizado. El potencial de ionización se media en voltios. En la actualidad, sin embargo, se mide en electrón-voltios (aunque no es una unidad de SL) o en julios por mol. El sinónimo energía de ionización (El) se utiliza con frecuencia. La energía para separar el electrón unido más débilmente al átomo es el primer potencial de ionización; sin embargo, hay alguna ambigüedad en la terminología. Así, en química, el segundo potencial de ionización del litio seria la energía del proceso.
En física, el segundo potencial de ionización es la energía requerida para separar un electrón del nivel siguiente al nivel de energía más alto del átomo neutro o molécula, p.
Grupo 1 2 3 4 5 6 7 8 9 10 11 12Elementos del grupo 18|18]] Periodo 1 H
1312He
23722 Li
520Be
899B
800C
1086N
1402O
1313F
1681Ne
20803 Na
496Mg
738Al
577Si
786P
1012S
1000Cl
1251Ar
15214 K
419Ca
590Sc
633Ti
659V
651Cr
653Mn
717Fe
762Co
760Ni
737Cu
745Zn
906Ga
579Ge
762As
947Se
941Br
1140Kr
13515 Rb
403Sr
549Y
600Zr
640Nb
652Mo
684Tc
702Ru
710Rh
720Pd
804Ag
731Cd
868In
558Sn
708Sb
834Te
869I
1008Xe
11706 Cs
376Ba
503Lu
523Hf
658Ta
761W
770Re
760Os
840Ir
880Pt
870Au
890Hg
1007Tl
589Pb
715Bi
703Po
812At
920Rn
10377 Fr
380Ra
509Lr
Rf
Db
Sg
Bh
Hs
Mt
Ds
Uuu
Uub
Uut
Uuq
Uup
Uuh
Uus
Uuo
Tabla periódica del primer potencial de ionización, en kJ/mol Véase también
- Electroafinidad
Categorías: Propiedades periódicas | Iones | Física molecular
Wikimedia foundation. 2010.
