- Enlace de tres centros y cuatro electrones
-
Enlace de tres centros y cuatro electrones
El enlace de tres centros y cuatro electrones (3c-4e) es un modelo usado para explicar el enlace en moléculas hipervalentes, tales como el pentafluoruro de fósforo, hexafluoruro de azufre, los fluoruros de xenón, y el anión hidrógenodifluoruro.[1] También es conocido como el modelo de tres centros de Pimentel-Rundle, por el trabajo publicado por George C. Pimentel en 1951,[2] que construye este modelo en base a desarrollos previos por Robert E. Rundle para enlaces con deficiencia de electrones.[3]
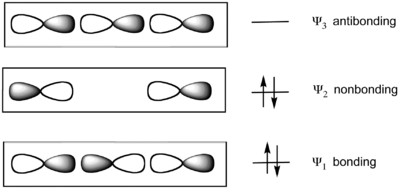
El modelo considera un enlace de tres átomos colineales. Por ejemplo, en el XeF2, la subunidad lineal de F-Xe-F es descrita por un conjunto de tres orbitales moleculares, derivados de los orbitales p colineales en cada átomo. Los enlaces Xe-F resultan de la combinación de un orbital p lleno en el átomo central, con dos orbitales p semillenos en los átomos axiales (F), resultando en un orbital enlazante lleno, un orbital no enlazante también lleno, y un orbital antienlazante vacío. Los dos orbitales moleculares de menor energía están doblemente ocupados. El HOMO está localizando en los dos átomos terminales. Esta localización de la carga está acomodada por el hecho de que los dos ligantes terminales son altamente electronegativos en moléculas hipervalentes. Las moléculas PF5 y SF4 son descritos, de acuerdo a este modelo, como teniendo un enlace 3c-4e, así como tres y dos enlaces de dos centros, respectivamente. En el SF6 y en los fluoruros de xenón, todos los enlaces son descritos con el modelo de tres centros y cuatro electrones.
El enlace en el XeF2 puede ser mostrado cualitativamente usando estructuras de Lewis resonantes, como se muestra a continuación:
![\bigg[\ F \frac{\quad}{\quad} Xe^+ \ {}^-\!F \quad \longleftrightarrow \quad F^- \ {}^+\!Xe \frac{\quad}{\quad} F\ \bigg]](/pictures/eswiki/57/99298f09e7cc6a57467bea4ee36bf08e.png)
En esta representación, la [[regla del octeto no se rompe, los orden de enlace son de 1/2, y hay una densidad electrónica aumentada en los átomos de flúor. Estos resultados son consistentes con el esquema de orbitales moleculares discutido arriba.
Los modelos más antiguos para explicar la hipervalencia involucraban orbitales d. Al 2008, estos modelos aún aparecían en algunos textos superiores introductorios; sin embargo, los cálculos de química cuántica sugieren que la participación de los orbitales d es despreciable, debido a la gran diferencia de energía entre los orbitales p (llenos), y los orbitales d (vacíos). Más aún, debe hacerse una distinción entre los "orbitales d" en el sentido de enlace de valencia, y las "funciones d", que están incluidasa en los cálculos de mecánica cuántica como funciones de polarización.[4] El modelo de tres centros y cuatro electrones tiene la ventaja de excluir la necesidad de necesitar orbitales d, que ha conducido a su aceptación.[5]
Referencias
- ↑ Weinhold, F.; Landis, C. Valency and bonding, Cambridge, 2005; pp. 275-306.
- ↑ Pimentel, G. C. The Bonding of Trihalide and Bifluoride Ions by the Molecular Orbital Method. J. Chem. Phys. 1951, 19, 446-448. DOI 10.1063/1.1748245
- ↑ Rundle, R. E. Electron Deficient Compounds. II. Relative Energies of "Half-Bonds". J. Chem. Phys 1949, 17, 671-675.DOI 10.1063/1.1747367
- ↑ E. Magnusson. Hypercoordinate molecules of second-row elements: d functions or d orbitals? J. Am. Chem. Soc. 1990, 112, 7940-7951. DOI 10.1021/ja00178a014
- ↑ Ramsden, C. A. Non-bonding molecular orbitals and the chemistry of non-classical organic molecules. Chem. Soc. Rev. 1994, 111-118. DOI 10.1039/CS9942300111
Categoría: Enlace químico
Wikimedia foundation. 2010.