- Diborano
-
Diborano
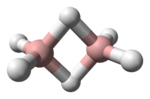 diborano
diboranoNombre (IUPAC) sistemático diborano(6) General Fórmula semidesarrollada B2H6 Fórmula molecular n/d Identificadores Número CAS 19287-45-7 Propiedades físicas Estado de agregación gas Apariencia incolora Densidad 1,18 kg/m3; 0,00118 g/cm3 Masa molar 27.67 g/mol g/mol Punto de fusión 108,15 K (-165 °C) Punto de ebullición 180,65 K (-92,5 °C) Propiedades químicas Solubilidad en agua reacciona KPS reacciona Termoquímica ΔfH0sólido reacciona kJ/mol Peligrosidad NFPA 704 Temperatura de autoignición 311 K (38 °C) Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl diborano es el compuesto químico que consiste de boro e hidrógeno con la fórmula B2H6. Es un gas incoloro a temperatura ambiente, con un olor dulce repulsivo. El diborano se mezcla bien con el aire, formando fácilmente mezclas explosivas. El diborano se encenderá espontáneamente en aire húmero a temperatura ambiente. Algunos sinónimos son boroetano, hidruro de boro, y hexahidruro de diboro.
El diborano es un compuesto clave de boro con una diversidad de aplicaciones. El compuesto está clasificado como "endotérmico", lo que significa que su entalpía de formación, ΔH°f, es positivo (36 kJ/mol). A pesar de su inestabilidad térmica, el diborano es cinéticamente robusto y exhibe una extensa química, mucha de la cual involucra la pérdida de hidrógeno.
Contenido
Estructura y enlace
El diborano adopta una estructura electrón de valencia restante para enlaces adicionales. Los átomos de hidrógeno de puente proveen un electrón cada uno. Entonces, el anillo de B2H2 se mantiene unido con cuatro electrones, siendo un ejemplo de enlace de 3-centros-2-electrones. Este tipo de enlace es llamado algunas veces un 'enlace banana'. Las longitudes de los enlaces B-Hpuente y B-Hterminal son 1.33 y 1.19 Å respectivamente, y esta diferencia en las longitudes de estos enlaces refleja la diferencia en su fuerza, siendo los enlaces B-Hpuente relativamente más débiles. La estructura es isoelectrónica con C2H62+, que surgiría de la diprotonación de la molécula plana de eteno.[1] El diborano es uno de muchos compuestos con tales enlaces inusuales.[2]
De los otros elementos en el Grupo 13, el galio es conocido por formar un compuesto similar, el digalano, Ga2H6. El aluminio forma un hidruro polimérico, hidruro de aluminio (AlH3)n, aunque también se ha aislado el Al2H6 inestable en hidrógeno sólido, y es isoestructural con el diborano.[3] No se han encontrado aún hidruros de indio y talio.[4]
Producción y síntesis
El diborano es tan importante y ha sido estudiado tan intensivamente que existen muchas síntesis. La mayoría de preparaciones involucran a reacciones entre donantes de hidrógeno con halogenuros o alcóxidos. La síntesis industrial involucra la reducción del BF3:
- 2 NaH → B2H6 + 6 NaF
Dos métodos de laboratorio empiezan del tricloruro de boro con hidruro de aluminio y litio, o de la solución en éter del trifluoruro de boro con el borohidruro de sodio.
Ambos métodos tienen un rendimiento hasta de 30% de diborano:
- 4 BCl3 + 3 LiAlH4 → 2 B2H6 + 3 LiAlCl4
- 4 BF3 + 3 NaBH4 → 2 B2H6 + 3 NaBF4
Los métodos más antiguos incluyen la reacción directa de las sales de borohidruro con un ácido no oxidante, como el ácido fosfórico o ácido sulfúrico diluido.
- 2 BH4− + 2 H+ → 2H2 + B2H6
De modo similar, se ha mostrado la oxidación de las sales de borohidruro, y aún es conveniente para preparaciones a pequeña escala:
Reacciones
El diborano es un reactante altamente reactivo y versátil, que tiene un gran número de aplicaciones.[5] Su esquema de reacción dominante involucra la formación de aductos con bases de LEwis. Frecuentemente, tales aductos iniciales proceden rápidamente para dar otros productos. Reacciona con amoníaco para formar borazano o el diamoniato del diborano, DADB, dependiendo de las condiciones usadas. El diborano también reacciona fácilmente con los alquinos para formar productos alquenos sustituidos, los que pueden sufrir posteriores reacciones de adición.
El diborano reacciona con el agua para formar hidrógeno y ácido bórico.
El compuesto forma complejos con bases de Lewis. Notables son los complejos con el THF y el sulfuro de dimetilo, ambos compuestos líquidos son populares agentes reductores en química orgánica. En estos complejos 1:1, el boro asume una geometría tetraédrica, estando enlazado a tres hidruros y a la base de Lewis (THF o Me2S). El aducto de THF se suele preparar como una solución 1:5 en tetrahidrofurano. El último es indefinidamente estable cuando se almacena en atmósfera de nitrógeno a temperatura ambiente.
Reactivo en síntesis orgánica
El diborano es un reactivo central en síntesis orgánica para la hidroboración, donde los alquenos adicionan los enlaces B-H en forma cruzada, para dar trialquilboranos:
- (THF)BH3 + 3 CH2=CHR → B(CH2CH2R)3 + THF
Esta reacción es regioselectiva, y los productos trialquilboranos pueden ser convertidos a otros derivados orgánicos útiles. Con alquenos voluminos, se puede preparar especies de forma general [HBR2]2, que también son reactivos muy útiles en aplicaciones más especializadas.
El diborano es usado como un agente reductor complementando la reactividad del hidruro de aluminio y litio. El compuesto reduce fácilmente a los ácidos carboxílicos a los alcoholes correspondientes, mientras que las cetonas reaccionan lentamente.
Historia
El diborano fue sintetizado por primera vez en el siglo XIX por hidrólisis de boruros de metal, pero no fue analizado. Desde 1912 a 1936, el gran pionero de la química de los hidruros de boro, Alfred Stock llevó a cabo su investigación que condujo a métodos para la síntesis y manejo de los altamente reactivos, volátiles, y frecuentemente tóxicos hidruros de boro. Fue él quien propuso la primera estructura similar al etano para el diborano.[6] La difracción de electrones de S. H. Bauer pareció soportar inicialmente dicha estructura.[7] [8]
Debido a una comunicación personal con Linus Pauling (quien apoyaba la estructura semejante al etano), Hermann Irving Schlesinger no discutió específicamente el enlace de tres centros 2 electrones en su entonces clásica revisión a inicios de la década de 1940.[9] Sin embargo, la revisión discute la estructura C2v en alguna profundidad. "Se reconoce que esta formulación fácilmente concuerda para muchas de las propiedades químicas del diborano...".
En 1943, un estudiante de antegrado del Balliol College, Oxford, H. Christopher Longuet-Higgins, publicó la estructura actualmente aceptada, junto con R. P. Bell.[10] Esta estructura había sido ya descrita en 1921.[11] [12] [13] The years following the Longuet-Higgins/Bell proposal witnessed a colorful discussion about the correct structure. El debate terminó con la medición de difracción de electrones en 1951 por K. Herberg y V. Schomaker, con la confirmación de la estructura en los esquemas de esta página.[14]
William Nunn Lipscomb, Jr. confirmó más aún la estructura molecular de los boranos usando cristalografía de rayos X en la década de 1950, y desarrolló teorías para explicar su enlace. Posteriormente, aplicó los mismos métodos a problemas relacionados, incluyendo la estructura de los carboranos hacia los que dirigió su investigación futura el ganador del Premio Nóbel Roald Hoffmann. Lipscomb recibió el Premio Nóbel de Química en 1976 por sus esfuerzos.
Otros usos
El diborano es utilizado propelentes de cohetes, como vulcanizador de gomas, como un catalizador para la polimerización de hidrocarburos, como un acelerador de llama, y como agente de dopado para la producción de semiconductores. También es un intermediario en la producción de boro de alta pureza para la producción de semiconductores.
Seguridad
Los efectos tóxicos del diborano son debidos principalmente a sus propiedades irritantes. La exposición por cortos períodos al diborano puede causar una sensación de pesadez del pecho, falta de aliento, tos, y mareo. Estos signos y síntomas pueden ocurrir inmediatamente o pueden ser retardados por hasta 24 horas. También puede presentarse irritación de piel y ojos. Los estudios en animales han mostrado que el diborano causa el mismo tipo de efectos observados en humanos.
Las personas expuestas por un período largo a pequeñas cantidades de diboran han experimentado irritación respiratoria, convulsiones, fatiga, somnolencia, confusión, y ocasionales temblores transientes.
Referencias
- ↑ G. Rasul, G. K. S. Prakash, G. A. Olah (2005). J. Phys. Chem. A. Vol. 109. n.º 5. pp. 798-801. DOI 10.1021/jp0404652.
- ↑ Laslo P (2000). «A Diborane Story» Angewandte Chemie International Edition. Vol. 39. pp. 2071–2072. DOI <2071::AID-ANIE2071>3.0.CO;2-C 10.1002/1521-3773(20000616)39:12<2071::AID-ANIE2071>3.0.CO;2-C. abstract
- ↑ Andrews, Lester; Wang, Xuefeng (2003). «The Infrared Spectrum of Al2H6 in Solid Hydrogen» Science. Vol. 299. n.º 5615. pp. 2049–2052. DOI 10.1126/science.1082456.
- ↑ Downs, Anthony J.; Colin R. Pulham (1994). «The hydrides of aluminium, gallium, indium and thallium: A re-evaluation» Chemical Society Reviews. Vol. 23. n.º 3. pp. 175–184. Cambridge: Royal Society of Chemistry. ISSN 0306-0012. DOI 10.1039/cs9942300175.
- ↑ Mikhailov BM (1962). «The Chemistry of Diborane» Russian Chemical Review. Vol. 31. n.º 31. pp. 207–224. DOI 10.1070/RC1962v031n04ABEH001281.
- ↑ Stock A. (1933). The Hydrides of Boron and Silicon. New York: Cornell University Press.
- ↑ Bauer S.H. (1937). «The Structure of Diborane» Journal of the American Chemical Society. Vol. 59. pp. 1096. DOI 10.1021/ja01285a041.
- ↑ Bauer S.H. (1942). «Structures and Physical Properties of the Hydrides of Boron and of their Derivatives» Chemical Reviews. Vol. 31. pp. 43–75. DOI 10.1021/cr60098a001.
- ↑ Schlesinger H.I., Burg A.B. (1942). «Recent Developments in the Chemistry of the Boron Hydrides» Chemical Reviews. Vol. 31. pp. 1–41. DOI 10.1039/JR9430000250.
- ↑ Longuet-Higgins, H.C., Bell, R.P. (1943). «The structure of the boron hydrides» Journal of the Chemical Society. pp. 250–255. DOI 10.1039/JR9430000250.
- ↑ Dilthey W. (1921). «Drehbrenner mit fester Gaszuführung» Zeitschriffte fuer Angewandte Chemie. Vol. 34. pp. 594. DOI 10.1002/ange.19210349504.
- ↑ Nekrassov BV (1940). J Gen Chem USSR. Vol. 10. pp. 1021.
- ↑ Nekrassov BV (1940). J Gen Chem USSR. Vol. 10. pp. 1056.
- ↑ Hedberg K, Schomaker V (1951). «A Reinvestigation of the Structures of Diborane and Ethane by Electron Diffraction» Journal of the American Chemical Society. Vol. 73. pp. 1482–1487. DOI 10.1021/ja01148a022.
Lecturas posteriores
H. C. Brown "Organic Synthesis via Boranes" John Wiley, New York, 1975. ISBN 0-471-11280-1.
Enlaces externos
- International Chemical Safety Card 0432
- National Pollutant Inventory - Boron and compounds
- NIOSH Pocket Guide to Chemical Hazards
- U.S. EPA Acute Exposure Guideline Levels
Categorías: Combustibles para cohetes | Compuestos de boro | Síntesis química
Wikimedia foundation. 2010.

