- Hidrógeno molecular protonado
-
El Hidrógeno molecular protonado, catión trihidrógeno, o H3+, es uno de los iones más abundantes del Universo. Es estable en el medio interestelar debido a la baja temperatura y baja densidad del espacio interestelar. El ion H3+ posee gran importancia en la química en fase gaeosa del medio interestelar, sin paralelo con ningún otro ion poliatómico. Este catión es también la molécula triatómica más simple, ya que sus dos electrones son los únicos electrones de valencia del sistema. Es asimismo un ejemplo de sistema de enlace de tres centros y dos electrones.
El hidrógeno triatómico[1] o trihidrógeno, H3 es una molécula de Rydberg de gran inestabilidad porque su estado electrónico fundamental es disociativo pero sus estados excitados o estados de Rydberg poseen una vida media relativamente alta comparadas con sus periodos vibracionales y rotacionales. Sin embargo el catión H3+ (hidrógeno molecular protonado o catión trihidrógeno)es estable.[2]
Contenido
Historia
El ion H3+ fue descubierto por J.J. Thomson en 1911 al estudiar las especies químicas contenidas en el gas sometido a descarga eléctrica en los tubos de rayos catódicos.[3] Usando una forma primitiva de espectrometría de masas, descubrió un gran número de iones moleculares con una relación masa-carga igual a 3. Estableció dos posibles hipótesis que corresponderían a los iones C4+ o bien H3+. Puesto que C4+ sería muy improbable y la cantidad obtenida crecía si el gas del tubo era hidrógeno puro, dedujo correctamente que se trataba de H3+.
El mecanismo de formación fue descubierto por Hogness & Lunn en 1925[4] que también emplearon una forma primaria de espectrometría de masas para estudiar los productos obtenidos tras someter al hidrógeno a descarga eléctrica. Observaron que la cantidad de H3+ aumentaba con la presión del gas hidrógeno del tubo, al mismo tiempo que disminuía linealmente la cantidad de H2+. Además, para cualquier presión, la presencia de H+ era escasa. Estos datos sugerían un mecanismo de formación por intercambio de protón, que se muestra en el apartado de formación.
En 1961, Martin et al. sugirieron en primer lugar que H3+ puede estar presente en el espacio interestelar debido a la gran cantidad de hidrógeno en dicho medio y a que su hipotético mecanismo de reacción era exotérmico (~1.5 eV).[5] Esto condujo a la sugerencia de Watson y Herbst & Klemperer en 1973 de que el H3+ es responsable de la formación de muchos iones moleculares observados.[6] [7]
Hasta 1980 no se descubrió el espectro de H3+ por parte de Takeshi Oka.[8] Estaba en la banda fundamental ν2 y utilizó una técnica llamada detección por modulación de frecuencia. Esto dio comienzo a la búsqueda del H3+ interestelar. Las líneas de emision fueron detectadas a finales de los 1980s y comienzos de los 1990s en las ionosferas de Júpiter, Saturno, y Urano.[9] [10] [11] En 1996, se detectó finalmente H3+ en el medio interestelar por parte de Geballe & Oka en dos nubes interestelares moleculares interstellar clouds en las trayectorias hasta GL2136 and W33A.[12] In 1998, H3+ was unexpectedly detected by McCall et al. in a diffuse interstellar cloud in the sightline Cyg OB2 No. 12.[13]
Estructura
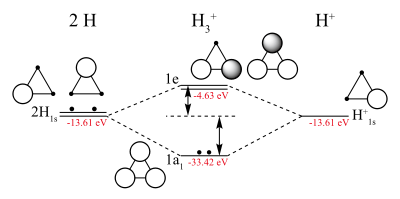
La ordenación de los átomos de hidrógeno en la molécula es un triángulo equilátero. La molécula tiene una estructura resonante que corresponde a un enlace de tres centros y dos electrones. La fuerza del enlace ha sido calculada y es aproximadamente 4.5 eV (104 kcal/mol ó 24,9 kJ/mol).[14] Esta molécula es un buen ejemplo que ilustra la importancia de la deslocalización del par de electrones que contribuye a la estabilidad de las moléculas.
Formación
El principal mecanismo para la producción de H3+ ha sido propuesto por E. Herbst[15] y consiste en la reacción entre el catión dihidrógeno, H2+, y el hidrógeno molecular, H2, con liberación de átomos de hidrógeno, H.

La concentración de iones H2+ es la que limita esta reacción. Los iones H3+ sólo pueden generarse en el espacio interestelar, por la existencia de H2 ionizado por rayos cósmicos.

Sin embargo,los rayos cósmicos tienen tanta energía que serán relativamente poco afectados, dado que la energía requerida para ionizar la molécula de H3+ es pequeña en términos relativos. En las nubes interestelares, los rayos cósmicos dejan tras de sí una cola de iones H2+, y de H3+. En laboratorios, los iones H3+ se producen por el mismo mecanismo de células de descarga en plasma,donde la descarga eléctrica suministra la energía para ionizar las moléculas H2.
Destrucción
Hay muchas reacciones de destrucción[15] del H3+. El camino de destrucción dominante en nubes interestelares densas es por transferencia de protón tras una colisión neutra. El candidato más probable para una colisión destructiva es la segunda molécula más abundante en el espacio, monóxido de carbono, CO.

El producto significativo de esta reacción es HCO+, una molécula importante para la química interestelar. Su gran momento dipolar y elevada abundancia relativa la hacen fácilmente detectable por radioastronomía. H3+ también puede reacccionar con oxígeno atómico para formar OH+ and H2.

Los iones OH+ reaccionan habituamente con más H2 para formar moléculas hidrogenadas.


Llegados a este punto, la reacción entre OH3+ y H2 ya no es exotérmica en nubes interestelares. El mecanismo de destrucción más frecuente para OH3+ es la recombinación disociativa, que produce cuatro posibles conjuntos de productos:
- H2O + H,
- OH + H2,
- OH + 2H, y
- O + H2 + H.
El agua es un posible producto de la reacción, pero posee un rendimiento muy bajo. Diferentes experimentos han sugerido que el agua se crea en cualquier sitio un 5% - 33% del tiempo. La conversión en H2 y H sólo ocurre en torno al 25% del tiempo.
El mecanismo de destrucción más frecuente para H3+ es también la recombinación disociativa, que produce múltiple productos, siendola reacción más frecuente la que produce tres átomos de hidrógeno, la cual ocurre aproximadamente el 75% del tiempo. Es de menos importancia la formación de H2 and H, que ocurre aproximadamente un 25% del tiempo. La formación de agua en el polvo cósmico es todavía considerada la fuente primaria de agua en el medio interestelar.
Isómeros orto y para del H3+
Archivo:H3+H2.pngUna colisión entre orto-H3+ y para-H2.La molécula más abundante en las nubes interestelares densas es el hidrógeno H2. Cuando una molécula de H3+ colisiona con H2, estquiométricamente no hay rendimiento neto. Sin embargo, una transferencia de un protón todavía puede tener lugar, lo cual cambia potencialmente el espín espín nuclear total de las dos moléculas, dependiendo de los espines nucleares de los protones. Para el H3+ son posibles dos configuraciones distintas llamadas orto y para.
- Orto-H3+ tiene los tres protones con espines paralelos, de lo que resulta un espín total de 3/2.
- Para-H3+ tiene dos protones con espines paralelos y un tercero que es antiparalelo, lo que da un espín total de 1/2.
De igual manera, H2 tiene también isómeros de espín del hidrógeno o estados orto y para, donde orto-H2 tiene un espín nuclear de 1, mientras la forma para-H2 tiene un espín nuclear total de 0. Cuando una molécula de orto-H3+ y otra de para-H2 colisionan, el potón transferido cambia los espines totales de lasdosmoléculas, generando un para-H3+ y un orto-H2.[15]
Espectroscopía
La espectroscopía del H3+ requiere mucho esfuerzo. Debido a su falta de momento dipolar permanente, la espectroscopía rotacional pura del H3+ es imposible. La luz ultravioleta es demasiado energética y disociaría la molécula. La espectroscopía de excitación rovibrónica provee la posibilidad de observar el H3+. La espectroscopía rovibrónica es posible con el H3+ porque uno de los modos de vibración de esta molécula, el modo de enlace asimétrico ν2, tiene un débil momento dipolar. En el espectro inicial realizado por Oka,[8] se detectaron unas 900 líneas de absorción en la región infrarroja. Las líneas de emisión del H3+ también han sido observadas en las atmósferas de los planetas jovianos. Las líneas de emisión del H3+ también se observan en los espectros de hidrógeno molecular buscando líneas que no pueden atribuirse al hidrógeno molecular.
Detección astronómica
Se han detectado moléculas de H3+ en dos entornos astronómicos: los planetas jovianos y las nubes interestelares. En los planetas jovianos, se ha detectado en las ionosferas, la región donde la radiación de alta energía procedente del Sol ioniza las partículas atmosféricas. Puesto qye hay un elevado nivel de H2 en esas atmósferas, la radiación produce una cantidad significativa de H3+. También, con una fuente tan extensa como el Sol, hay mucha radiación para excitar las moléculas de H3+ a estados energéticos más altos desde los que pueden relajarse por emisión estimulada y espontánea.
Atmósferas planetarias
La detección de las primeras líneas de emisión de H3+ fue registrada en 1989 por Drossart et al.,[9] en la ionosfera de Júpiter. Drossart encontró un total de 23 líneas de H3+ con una densidad de columna de 1.39 * 109 cm-2. Usando estas líneas, fueron capaces de asignar una temperatura del H3+ de ~1.100 K (826,85 °C), que es comparable a las temperaturas determinadas de las líneas de emisión de otras especies como H2. En 1993, H3+ fue encontrado en Saturno por Geballe et al.[10] y en Urano por Trafton et al.[11]
Nubes moleculares interestelares
No se detectó H3+ en el medio interestelar hasta 1996, cuando Geballe & Oka informaron sobre la detección de H3+ en dos nubes moleculares visibles, GL2136 y W33A.[12] Ambas fuentes tenían temperaturas de H3+ de aproximadamente 35 K (-238 °C) y densidades de columna de aproximadamente 1014 cm-2. Desde entonces, se ha detectado H3+ en otras numerosas nubes moleculares, como AFGL 2136,[16] Mon R2 IRS 3,[16] GCS 3-2,[17] GC IRS 3,[17] y LkHα 101.[18]
Nubes interestelares difusas
De modo inesperado, se detectaron tres líneas de H3+ en 1998 por McCall et al. en la nube difusa de Cyg OB2 No. 12.[13] Antes de 1998, se pensaba que la densidad de H2 era demasiado baja para producir una cantidad detectable de H3+. McCall detectó una temperatura de ~27 K (-246 °C) y una densidad de columna de ~ 1014 cm-2, el mismo valor encontrado por Geballe & Oka. Desde entonces, se ha detectado H3+ en otras muchas nubes difusas, como GCS 3-2,[17] GC IRS 3,[17] y ζ Persei.[19]
Predicciones del modelo del estado contínuo
Para aproximar laclongitud de camino del H3+ en estas nubes, Oka[20] empleó el modelo del estado contínuo para determinar las densidades de número predichas en nubes densas y difusas. Como se explicaba más arriba, ambos tipos de nubes tienen el mismo mecanismo de formación para, pero diferentes mecanismos dominantes de destrucción. En nubes densas, la transferencia de protón con CO es el mecanismo de destrucción dominante. Esto corresponde a una densidad de número de 10-4 cm-3 en nubes densas.
- n(H3+) = (ζ / kCO)[n(H2) / n(CO)] ≈ 10-4 cm-3
- n(H3+) = (ζ / ke)[n(H2) / n(C+)] ≈ 10-6 cm-3
En nubes difusas, el mecanismo de destrucción dominante es la recombinación disociativa. Esto corresponde a una densidad de número de 10-6 cm-3 en nubes difusas. Por tanto, ya que las densidades de columna para nubes difusas y densas son aproximadamente del mismo orden de magnitud, las nubes difusas deben tener una longitud de camino 100 veces mayor que para nubes densas. Y por consiguiente, empleando el H3+ como una sonda en estas nubes, se puede determinar su tamaño relativo.
Véase también
- Hidrógeno molecular o dihidrógeno, H2
- Catión dihidrógeno, H2+
- Trihidrógeno, H3
Referencias
- ↑ Triatomic Hydrogen. Department of Molecular and Optical Physics, University of Freiburg, Germany.
- ↑ Raynor, Susanne; Herschbach Dudley R.. «Electronic structure of Rydberg states of triatomic hydrogen, neon hydride, hydrogen fluoride (H2F), H3O, NH4 and CH5 molecules.» (en Inglés). J. Phys. Chem., 1982, (DOI: 10.1021/j100215a020: ACS) 86 ((18)): pp. 3592–3598. http://pubs.acs.org/doi/abs/10.1021/j100215a020. Consultado el 15-nov-2009.
- ↑ Thomson, J. J. (1913). «Rays of Positive Electricity». Proceedings of the Royal Society A 89 (607): pp. 1–20. doi:.
- ↑ Hogness, T. R.; Lunn, E. G. (1925). «The Ionization of Hydrogen by Electron Impact as Interpreted by Positive Ray Analysis». Physical Review 26 (1): pp. 44–55. doi:.
- ↑ Martin, D. W.; McDaniel, E. W.; Meeks, M. L. (1961). «On the Possible Occurrence of H3+ in Interstellar Space». Astrophysical Journal 134: pp. 1012.
- ↑ Watson, W. D. (1973). «The Rate of Formation of Interstellar Molecules by Ion-Molecule Reactions». Astrophysical Journal 183 (2): pp. L17. doi:.
- ↑ Herbst, E.; Klemperer, W. (1973). «The Formation and Depletion of Molecules in Dense Interstellar Clouds». Astrophysical Journal 185: pp. 505. doi:.
- ↑ a b Oka, T. (1980). «Observation of the Infrared Spectrum of H3+». Physical Review Letters 45: pp. 531–534. doi:.
- ↑ a b Drossart, P.; et al. (1989). «Detection of H3+ on Jupiter». Nature 340 (6234): pp. 539. doi:.
- ↑ a b Geballe, T. R.; et al. (1993). «Detection of H3+ Infrared Emission Lines in Saturn». Astrophysical Journal 408 (2): pp. L109. doi:.
- ↑ a b Trafton, L. M.; et al. (1993). «Detection of H3+ from Uranus». Astrophysical Journal 405: pp. 761. doi:.
- ↑ a b Geballe, T. R.; Oka, T. (1996). «Detection of H3+ in Interstellar Space». Nature 384 (6607): pp. 334–335. doi:.
- ↑ a b McCall, B. J.; et al. (1998). «Detection of H3+ in the Diffuse Interstellar Meduim Toward Cygnus OB2 No. 12». Science 279 (5358): pp. 1910–1913. doi:.
- ↑ McCall, B. J.; et al. (2004). «Dissociative Recombination of Rotationally Cold H3+». Physical Review A 70 (5): pp. 052716. doi:.
- ↑ a b c Herbst, E. (2000). «The Astrochemistry of H3+». Phil. Trans. R. Soc. Lond. A. 358 (1774): pp. 2523–2534. doi:.
- ↑ a b McCall, B. J.; et al. (1999). «Observations of H3+ in Dense Molecular Clouds». Astrophysical Journal 522: pp. 338–348. doi:.
- ↑ a b c d Goto, M.; et al. (2002). «Absorption Line Survey of H3+ toward the Galactic Center Sources I. GCS 3-2 and GC IRS3». Astron. Soc. Japan 54: pp. 951.
- ↑ Brittain, S. D.; et al. (2004). «Interstellar H3+ Line Absorption toward LkHα 101». Astrophysical Journal 606: pp. 911–916. doi:.
- ↑ McCall, B. J.; et al. (2003). «An Enhanced Cosmic-ray Flux towards ζ Persei Inferred from a Laboratory Study of the H3+-e- Recombination Rate». Nature 422 (6931): pp. 500. doi:.
- ↑ Oka, T. (2006). «Interstellar H3+». PNAS 103 (33): pp. 12235–12242. doi:.
Enlaces externos
- H3+ Centro de recursos sobre H3+ (en inglés)
- Astrochemistry.net (en inglés)
Categorías:- Cationes
- Astroquímica
- Hidrógeno
Wikimedia foundation. 2010.