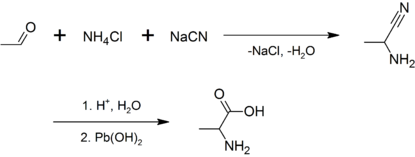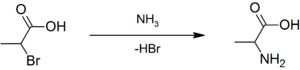- Alanina
-
Alanina

Nombre (IUPAC) sistemático Ácido 2-aminopropanoico General Símbolo Ala, A Fórmula molecular C3H7NO2 Identificadores Número CAS 56-41-7 PubChem Propiedades físicas Densidad 1401 kg/m3; 1,401 g/cm3 Masa molar 89,09 g/mol Punto de fusión 570 K (296,85 °C) Propiedades químicas Acidez (pKa) 2,33; 9,71 Solubilidad en agua 166,5 g/l Bioquímica Familia Aminoácido Esencial No Codón GCU, GCC, GCA, GCG Punto isoeléctrico (pH) 6,11 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasAlanina (Ala o A) es uno de los aminoácidos que forman las proteínas de los seres vivos. Es codificada por los codones GCU, GCC, GCA y GCG. Es el aminoácido más pequeño después de la glicina y se clasifica como hidrófobico.
La alanina es un aminoácido no esencial para el ser humano pero es de una importancia. Existe en dos distintos enantiómeros - L-alanina y D-alanina. La L-alanina es uno de los 20 aminoácidos más ampliamente usados en biosíntesis de proteína, detrás de la leucina, encontrándose en un 7,8 % de las estructuras primarias, en una muestra de 1.150 proteínas.[1] La D-alanina está en las paredes celulares bacteriales y en algunos péptidos antibióticos. Se encuentra tanto en el interior como en el exterior de las proteínas globulares.
Contenido
Estructura
El átomo de carbono α de la alanina está enlazado con un grupo metil (-CH3), siendo por tanto clasificada como un aminoácido alifático.
Biosíntesis
La alanina es muy común por transferir su grupo amino al piruvato. Debido a las reacciones de transaminación a través de la enzima alanina transaminasa (EC 2.6.1.2), la cual es rápidamente reversible, la alanina puede fácilmente biosintetizarse del piruvato, por lo que está presente en los ciclos metabólicos de la glicólisis, gluconeogénesis, y en el ciclo del ácido cítrico.
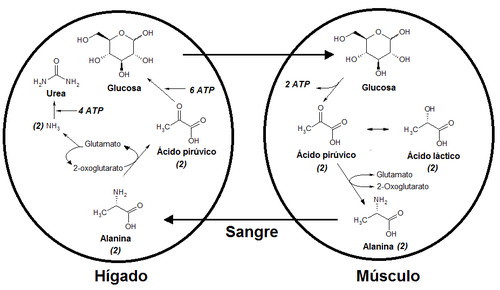 Distribución de la glucosa, alanina y ácido láctico (V. Ciclo de Cori)
Distribución de la glucosa, alanina y ácido láctico (V. Ciclo de Cori)
Alternativamente, las bacterias obtienen alanina por descarboxilación del carbono 4 del aspartato, por acción de la enzima aspartato 4-descarboxilasa (EC 4.1.1.12), llevándose a cabo la siguiente reacción:
HOOC-CH2-CH(NH2)-COOH → CO2 + CH3-CH(NH2)-COOH
Síntesis
La alanina racémica puede ser sintetizada por la condensación del acetaldehído con cloruro de amonio en la presencia de cianuro de sodio a través de una síntesis de Strecker, o por amonólisis del ácido 2-bromopropiónico:[2]
Función
El grupo metil de la alanina es muy poco reactivo, por lo que no es común verlo en la función proteica. Sin embargo, puede desempeñar un papel en el reconocimiento del sustrato o especificidad, particularmente en interacciones con otros átomos no reactivos como el carbono. Interviene en el metabolismo de la glucosa.
Fuentes de alanina
En general, las proteínas de la carne de vacuno, cerdo, pescado, huevos y productos lácteos son ricas en alanina.
Referencias
- ↑ Doolittle RF (1989). "Redundancias en secuencias de proteínas" en Predicción de estructuras proteicas y los principios de la conformación de proteínas'. (Fasman GD, ed.), pp 599-623, Plenum Press, New York.
- ↑ (1929) "dl-Alanine". Org. Synth. 9: 4; Coll. Vol. 1: 21. .
Véase también
Enlaces externos
Categorías:- Aminoácidos
- Aminoácidos neutros no polares
- Aminoácidos glucogénicos
Wikimedia foundation. 2010.