- Hélice-bucle-hélice
-
Una hélice-bucle-hélice básica (bHLH por sus siglas en inglés) es un motivo estructural de proteínas que caracteriza a una familia de factores de transcripción.[1] [2] [3]
Contenido
Estructura
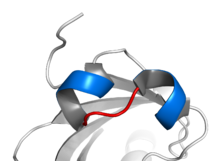
El motivo se caracteriza por dos hélices alfa conectadas por un bucle. En general, los factores de transcripción que incluyen este dominio son diméricos, cada uno con una hélice conteniendo aminoácidos básicos que facilitan la unión a ADN.[4] En general, una hélice es más pequeña, y, debido a la flexibilidad del bucle, permite la dimerización plegándose y empaquetándose contra la otra hélice. La hélice de mayor tamaño generalmente contiene las regiones de unión al ADN. Las proteínas bHLH se unen a la secuencia de consenso llamada caja E, CANNTG.[5] La caja E clásica es CACGTG (palindrómica), sin embargo algunos factores de transcripción bHLH se unen a secuencias no palindrómicas, las cuales en ocasiones son similares a las de la caja E.
Regulación
Debido a que muchos factores de transcripción bHLH son heterodiméricos, su actividad está generalmente altamente regulada por la dimerización de sus subunidades. La expresión de una subunidad o su disponibilidad es con frecuencia controlada, mientras que la otra subunidad es expresada constitutivamente. Muchas de las proteínas reguladoras conocidas, tales como la proteína extramacrochaetae (emc) de Drosophila, tiene la estructura hélice-bucle-hélice pero carecen de la región básica, haciéndolas incapaces de unirse al ADN por su cuenta. Sin embargo, son capaces de formar heterodimeros con proteínas que tienen la estructura bHLH, e inactivar su capacidad como factores de transcripción.[6]
Historia
- 1989: Murre et al. pudieron demostrar que los dimeros de varias proteínas bHLH se unían a cortos motivos de ADN (llamados más tarde caja E).[7] Esta caja E consiste de una secuencia CANNTG de ADN, donde N puede ser cualquier nucleótido.[5]
Referencias
- ↑ Murre C, Bain G, van Dijk MA, Engel I, Furnari BA, Massari ME, Matthews JR, Quong MW, Rivera RR, Stuiver MH (junio 1994). «Structure and function of helix-loop-helix proteins». Biochim. Biophys. Acta 1218 (2): pp. 129–35. PMID 8018712. http://linkinghub.elsevier.com/retrieve/pii/0167-4781(94)90001-9.
- ↑ Littlewood TD, Evan GI (1995). «Transcription factors 2: helix-loop-helix». Protein Profile 2 (6): pp. 621–702. PMID 7553065.
- ↑ Massari ME, Murre C (enero 2000). «Helix-loop-helix proteins: regulators of transcription in eucaryotic organisms». Mol. Cell. Biol. 20 (2): pp. 429–40. doi:. PMID 10611221. PMC 85097. http://mcb.asm.org/cgi/pmidlookup?view=long&pmid=10611221.
- ↑ Lawrence Zipursky; Arnold Berk; Monty Krieger; Darnell, James E.; Lodish, Harvey F.; Kaiser, Chris; Matthew P Scott; Matsudaira, Paul T.. W. H. Freeman. ed. McGill Lodish 5E Package - Molecular Cell Biology & McGill Activation Code. San Francisco. ISBN 0-7167-8635-4.
- ↑ a b Chaudhary J, Skinner MK (1999). «Basic helix-loop-helix proteins can act at the E-box within the serum response element of the c-fos promoter to influence hormone-induced promoter activation in Sertoli cells». Mol. Endocrinol. 13 (5): pp. 774–86. doi:. PMID 10319327.
- ↑ Cabrera CV, Alonso MC, Huikeshoven H (1994). «Regulation of scute function by extramacrochaete in vitro and in vivo». Development 120 (12): pp. 3595–603. PMID 7821225.
- ↑ Murre C, McCaw PS, Vaessin H, et al. (1989). «Interactions between heterologous helix-loop-helix proteins generate complexes that bind specifically to a common DNA sequence». Cell 58 (3): pp. 537–44. doi:. PMID 2503252.
Enlaces externos
Categorías:- Estructura de las proteínas
- Factores de transcripción
Wikimedia foundation. 2010.