- Hélice beta
-
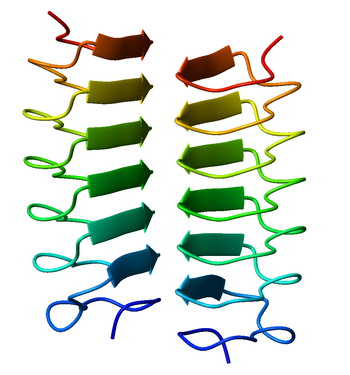 Hélice β dimérica, de sentido horario de la proteína anticongelante del escarabajo Tenebrio molitor (Código PDB 1EZG). Asociación cara a cara de hélices β.
Hélice β dimérica, de sentido horario de la proteína anticongelante del escarabajo Tenebrio molitor (Código PDB 1EZG). Asociación cara a cara de hélices β.
Una hélice beta es una estructura secundaria de proteínas formada de la asociación de láminas beta paralelas en un patrón helicoidal con dos o tres caras. La estructura se estabiliza por puentes de hidrógeno, interacciones proteína-proteína y, a veces por iones metálicos. Se han identificado hélices beta tanto en sentido horario como antihorario.
Contenido
Hélices de doble lámina
Las hélices beta más simples contienen dos "niveles" de láminas beta conectadas por seis bucles ricos en residuos de glicina que contienen invariablemente una aspartato que se une a un ion de calcio por bucle. Cada capa se compone de series casi planas de láminas beta en paralelo, enlazadas por puentes de hidrógeno y las dos capas juntas formando un núcleo hidrofóbico.
Hélices de triple lámina
Las hélices beta de tres láminas forman un prisma triangular distorsionado en el cual cada cara presenta puentes de hidrógeno paralelos entre láminas. Una de las tres hojas que forman el motivo estructural puede aparecer "doblado" en relación con los otros dos, que se encuentran enfrentados de forma similar a la le hélice beta de doble lámina. Dos de los tres bucles que enlazan las hojas pueden ser de una longitud arbitraria y puede incluso contener otros dominios estructurales, y el tercera se limita a solo dos residuos. Una repetición de hexapéptidos característica encontrado en hélices de ambos sentidos es: [LIV] − [GAED] − X2 − [STAV] − X. Las hélices beta de tres láminas son considerablemente más largas que su contraparte de dos láminas.
La primera hélice beta se observó en la enzima pectato liasa, que contiene una hélice de siete giros que llega a los 34 Å (3,4 nm) de longitud. Las proteínas de la cola del fago P22, poseen 13 vueltas y su homotrimero ensamblado es de 200 Å (20 nm) de longitud. Su interior está completamente cerrado sin poro central y contiene residuos hidrófobos y residuos neutralizados por puentes de sal.
Tanto la pectato liasa como las proteínas de la cola del fago P22 contienen proteínas que forman hélices de sentido horario; en sentido antihorario se han observado en enzimas, como la UDP-N-acetilglucosamina aciltransferasa y la anhidrasa carbónica de archaeas. Otras proteínas que contienen beta hélices son las proteínas anticongelantes del escarabajo Tenebrio molitor y la mariposa, Choristoneura fumiferana, donde treoninas espaciadas regularmente en hélices beta se unen a la superficie de los cristales de hielo e inhiben su crecimiento.
Las hélices beta pueden asociarse entre sí de manera eficaz, ya sea cara a cara (el apareamiento de las caras de su prisma triangular) o de extremo a extremo (formando puentes de hidrógeno). Por lo tanto, las hélices beta pueden ser utilizadas como "etiquetas" para inducir a otras proteínas a asociarse, de forma similar a una superhélice.
Referencias
- Branden C, Tooze J. (1999). Introduction to Protein Structure 2nd ed. Garland Publishing: New York, NY. pp 84-6.
- Dicker IB and Seetharam S. (1992) "What is Known about the Structure and Function of the Eschericia-coli Protein FirA" Mol. Microbiol., 6, 817-823.
- Kisker C, Schindelin H, Alber BE, Ferry JG and Rees DC. (1996) "A left-handed β-helix revealed by the crystal structure of a carbonic anhydrase from the achaeon Methanosarcina thermophile", EMBO J., 15, 2323-2330.
- Liou YC, Tocilj A, Davies PL and Jia Z. (2000) Mimicry of ice structure by surface hydroxyls and water of a beta-helix antifreeze protein." Nature, 406, 322-324.
- Leinala EK, Davies PL and Jia Z. (2002) "Crystal Structure of β-Helical Anitfreeze Protein Points to a General Ice Binding Model", Structure, 10, 619-627.
- Raetz CRH and Roderick SL. (1995) "A Left-Handed Parallel β Helix in the Structure of UDP-N-Acetylglucosamine Acyltransferase", Science, 270, 997-1000.
- Steinbacher S, Seckler R, Miller S, Steipe B, Huber R and Reinemer P. (1994) "Crystal structure of P22 tailspike protein: interdigitated subunits in a thermostable trimer", Science, 265, 383-386.
- Vaara M. (1992) "Eight bacterial proteins, including UDP-N-acetylglucosamine acyltransferase (LpxA) and three other transferases of Escherichia coli, consist of a six-residue periodicity theme", FEMS Microbiol. Lett, 97, 249-254.
- Yoder MD, Keen NT and Jurnak F. (1993) "New domain motif:the structure of pectate lyase C, a secreted plant virulence factor", Science, 260, 1503-1507.
Enlaces externos
Wikimedia foundation. 2010.

