- Hélice de poliprolina
-
En proteínas, la hélice de poliprolina habitualmente en sentido antihorario, llamada hélice poliprolina II (PPII o poli-Pro II) la cual se forma cuando todos los residuos secuenciales adoptan los ángulos diedros (φ, ψ) en su columna de aproximadamente (-75 °, 150 °) y poseen isómeros trans en sus enlaces peptídicos. Del mismo modo se forma una hélice más compacta y de sentido horario llamada hélice de poliprolina I (PPI, poli Pro-I) cuando todos los residuos adoptan los ángulos diedros (φ, ψ) de aproximadamente (-75 °, 160 °) y posee isómeros cis en sus enlaces peptídicos. De los veinte aminoácidos naturales, sólo la prolina es la que con mayor probabilidad forme isómeros cis en el enlace peptídico, en particular en el enlace X-Pro; factores estéricos y electrónicos favorecen en gran medida el isómero trans en la mayoría de los enlaces peptídicos. Sin embargo, los enlaces peptídicos que sustituyen la prolina con otro N-aminoácido sustituto (como la sarcosina) son también susceptibles de adoptar el isómero cis.
Contenido
Hélice de poliprolina II
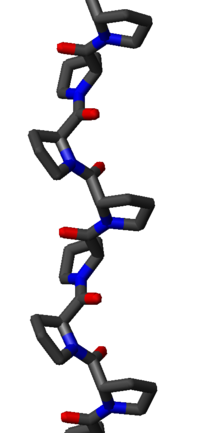
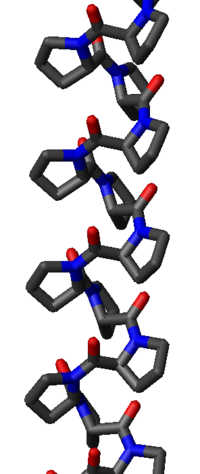
La hélice de poliprolina II es definida por los ángulos diedros (φ,ψ) de (-75°, 150°) e isómeros trans de los enlaces peptídicos.La fórmula general de rotación del ángulo Ω por residuo de cualquier hélice de polipéptidos con isómeros trans está dada por la ecuación:
La sustitución de los ángulos diedros (φ, ψ) para PPII en esta ecuación resulta en exactamente Ω = -120 °, es decir, la hélice PPII es antihoraria (ya que Ω es negativo) con tres residuos por vuelta. La traslación de residuos es de aproximadamente 3,1 Å. Esta estructura es algo similar a la adoptada en la proteína fibrosa colágeno, que se compone principalmente de prolina, hidroxiprolina y glicina. Las hélices PPII están específicamente enlazadas por dominios SH3, esta unión es importante para muchas interacciones proteína-proteína y las interacciones entre los dominios de una sola proteína.
Los ángulos diedros de la columna de la PPII (-75 °, 150 °) se observan con frecuencia en las proteínas, incluso aminoácidos distintos de prolina. La gráfica de Ramachandran es muy poblada en la región de PPII en la región, en comparación con la región en torno a la hoja beta (-135 °, 135 °). Por ejemplo, la columna de ángulos diedros para PPII se observa con frecuencia la estructura de giros, más comúnmente en el primer residuo de un giro beta tipo II. La "imagen especular" para los ángulos diedros de PPII (75 °, -150 °) es raramente vista, excepto en los polímeros del aminoácido aquiral glicina. El análogo de la hélice PPII en poli-glicina es llamado hélice poli-Gly II.
Hélice de poliprolina I
La hélice de poliprolina I es mucho más densa que la hélice PPII debido a los isómeros cis de sus enlaces peptídicos. También es menos frecuente que la conformación PPII porque el isómero cis es de mayor energía que la forma trans. Sus ángulos diedros típicos son (-75°, 160°), similares pero no idénticos a los de la hélice de PPII. Sin embargo la hélice de PPI es en sentido horario y más firmemente enrollada, con unos 3,3 residuos por giro (en lugar de los 3 de PPII). La traslación por residuo también es menor, de unos 1,9 Å. Nuevamente, no hay enlaces de hidrógeno internos en PPI, en ambas debido a que el átomo donante del enlace está ausente y porque el nitrógeno y oxígeno de la amida están demasiado distantes (unos 3,8 Å) y orientados incorrectamente.
La hélice PPII es relativamente abierta y no tiene enlaces de hidrógeno internos, a diferencia de otras estructuras helicoidales secundarias, como la hélice alfa, la hélice 310, la hélice pi o la hélice beta. Los átomos nitrógeno y oxígeno de la amida están demasiado distantes (aproximadamente 3,8 Å) y orientada incorrectamente como para un enlace de hidrógeno. A pesar de que estos dos átomos son aceptores de enlaces de hidrógeno en la prolina; no hay donantes de enlaces debido a la cadena lateral cíclica.
Propiedades estructurales
Las hélices de poliprolina son estables y rígidas a pesar de la ausencia de puentes de hidrógeno internos, y se han utilizado como una "regla molecular" en experimentos biofísicos, por ejemplo, para calibrar distancias medidas por FRET. Las interconversiones entre las formas de las hélices de PPI y PPII son lentas, debido a la alta energía de activación de la isomerización X-Pro cis-trans (Ea ≈ 20 kcal/mol); sin embargo, esta interconversión puede ser catalizada por isomerasas específicas conocida como prolil isomerasas o PPIasas.
Referencias
- Adzhubei AA and Sternberg MJE. (1993) "Left-handed Polyproline II Helices Commonly Occur in Globular Proteins", J. Mol. Biol., 229, 472-493.
Wikimedia foundation. 2010.