- Hélice 310
-
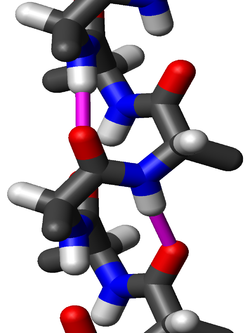 Vista lateral de una hélice 310 de residuos de alanina. En magenta se señalan dos enlaces de hidrógeno al mismo grupo peptídico; la distancia oxígeno-hidrógeno es de 1,83 Å. La cadena de la proteína se dirige hacia arriba; su extremo N-terminal está abajo y el C-terminal arriba. Las cadenas laterales apuntan ligeramente hacia el extremo N-terminal.
Vista lateral de una hélice 310 de residuos de alanina. En magenta se señalan dos enlaces de hidrógeno al mismo grupo peptídico; la distancia oxígeno-hidrógeno es de 1,83 Å. La cadena de la proteína se dirige hacia arriba; su extremo N-terminal está abajo y el C-terminal arriba. Las cadenas laterales apuntan ligeramente hacia el extremo N-terminal.
Una hélice 310 es un tipo de estructura secundaria de proteínas poco común.
Estructura
Los aminoácidos en una hélice 310 están dispuestos en una estructura helicoidal de sentido horario. Cada aminoácido corresponde a 120° de giro en la hélice (es decir, la hélice tiene tres residuos por vuelta) y una traslación de 2,0 Å (0,2 nm) a lo largo del eje de la hélice. El grupo N-H de un aminoácido forma un enlace por puente de hidrógeno con el grupo C=O del aminoácido tres residuos anterior; estos enlaces de hidrógeno repetidos i + 3 → i definen la hélice 310. Estructuras similares incluyen la hélice alfa (con enlaces de hidrógeno i + 4 → i) y la hélice pi (con enlaces de hidrógeno i + 5 → i).
Los residuos en una hélice 310 adoptan típicamente ángulos diedros (φ, ψ) cercanos a −49°, −26°, de tal forma que el ángulo ψ de un residuo y el ángulo φ del siguiente suman unos −75°. En comparación, la suma de ángulos diedros de una hélice alfa es de aproximadamente −105°, mientras que los de una hélice pi suman unos −125°.
La fórmula general de rotación del ángulo Ω por residuo de cualquier hélice polipeptídica con configuración trans está dada por la ecuación:
Referencias
- L. Pauling, R.B. Corey and H.R. Branson (1951) "The Structure of Proteins: Two Hydrogen-Bonded Helical Configurations of the Polypeptide Chain", Proc. Natl. Acad. Sci. USA 37: 205-211. PMCID:PMC1063337
Wikimedia foundation. 2010.

