- Hidrohalogenación
-
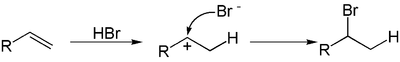
Una reacción de hidrohalogenación es la adición electrofílica de ácidos hidrácidos como el cloruro de hidrógeno o el bromuro de hidrógeno a alquenos para producir los correspondientes haloalcanos.[1] [2] [3]
Si los dos átomos de carbono en el enlace doble están unidos a un número diferente de átomos de hidrógeno, el halógeno se ubicará preferentemente en el carbono con menos sustituyentes hidrógeno, una observación conocida como regla de Markovnikov. Esto es debido a la abstracción de un átomo de hidrógeno del ácido (HX) por el alqueno, para formar el carbocatión más estable (estabilidad relativa: 3°>2°>1°>metilo), así como generando un anión halógeno.
La reacción subsecuente procede por un mecanismo SN1 debido a la presencia del carbocatión electrófilo y el anión haluro nucleófilo, conduciendo al producto final.
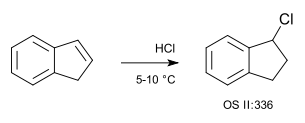
Un ejemplo simple de una hidrocloración es la del indeno con el gas de cloruro de hidrógeno (sin solvente):[4]
Adición anti-Markovnikov
En presencia de peróxido, el HBr se adiciona para producir un alqueno en una forma de adición anti-Markovnikov.[5] Esto es debido a que la reacción procede a través del radical intermediario de carbono más estable (estabilidad relativa: 3° > 2° > 1°>metilo), en vez de por un carbocatión. El mecanismo de la reacción es similar a una reacción en cadena como en la halogenación radicalaria, en la que el peróxido promueve la formación del radical de bromo. En consecuencia, en presencia de peróxidos, el HBr se adiciona tal que el átomo de bromo se adicione al carbono que tiene la mayor cantidad de sustituyentes de hidrógeno, y el átomo de hidrógeno se adicionará al carbono que tiene menos sustituyentes hidrógeno. Sin embargo, este proceso está restringido a la adición de HBr.
Ningún otro halogenuro de hidrógeno se comporta en la manera descrita anteriormente, esto puede ser explicado mediante un análisis rápido de los diferentes ácidos hidrácidos: HF (fluoruro de hidrógeno), HCl (cloruro de hidrógeno), y HI (yoduro de hidrógeno).
- El enlace hidrógeno-flúor es demasiado fuerte tal que no se forman suficientes radicales de flúor en la etapa de propagación.
- El cloruro de hidrógeno reaccionará tan lentamente que, sintéticamente, es inútil. Esto debido a que el enlace H-Cl también es un enlace fuerte.
- El enlace C-I es muy débil, tal que se genera insuficiente calor para continuar la fase de propagación.
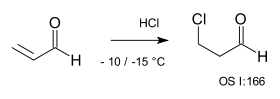
Con aceptores de Michael, la adición también es anti-Markovnikov, debido a que el nucleófilo X- reacciona en una adición nucleofílica conjugada, por ejemplo en la reacción de HCl con acroleína.[6]
Investigaciones recientes han encontrado que la adición de gel de sílice o alúmina a H-Cl (o H-Br) en diclorometano incrementa la velocidad de la reacción, haciendo que se más fácil que se lleve a cabo.
Referencias
- ↑ Solomons, T.W. Graham; Fryhle, Craig B. (2003), Organic Chemistry (8th edición), Wiley, ISBN 0471417998
- ↑ Smith, Janice G. (2007), Organic Chemistry (2nd edición), McGraw-Hill, ISBN 0073327492
- ↑ P.J. Kropp, K.A. Dans, S.D. Crawford, M.W. Tubergen, K.D. Kepler, S.L Craig, and V.P. Wilson (1990). «Surface-mediated reactions. 1. Hydrohalogenation of alkenes and alkynes». J. Am. Chem. Soc. 112 (112): pp. 7433–7434. doi:.
- ↑ R. A. Pacaud and C. F. H. Allen. "α-Hydroindone". Org. Synth.; Coll. Vol. 2: 336.
- ↑ March Jerry; (1885). Advanced Organic Chemistry reactions, mechanisms and structure (3rd ed.). New York: John Wiley & Sons, inc. ISBN 0-471-85472-7
- ↑ C. Moureu and R. Chaux (1941). "β-Chloropropionic acid". Org. Synth.; Coll. Vol. 1: 166.
Categoría:- Reacciones químicas orgánicas
Wikimedia foundation. 2010.