- Alótropos del carbono
-
Alótropos del carbono
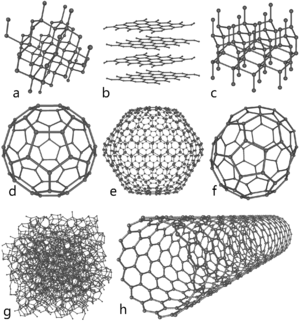 Ocho alótropos del carbono: a) Diamante, b) Grafito, c) Lonsdaleíta, d) C60 (Buckminsterfulereno or buckybola), e) C540, f) C70, g) Carbono amorfo, y h) nanotubo de carbono de pared simple o buckytubo.
Ocho alótropos del carbono: a) Diamante, b) Grafito, c) Lonsdaleíta, d) C60 (Buckminsterfulereno or buckybola), e) C540, f) C70, g) Carbono amorfo, y h) nanotubo de carbono de pared simple o buckytubo.
Esta es una lista de los alótropos del carbono.
Contenido
Diamante
El diamante es uno de los alótropos del carbono mejor conocidos, cuya dureza y alta dispersión de la luz lo hacen útil para aplicaciones industriales y joyería. El diamante es el mineral natural más duro conocido, lo que lo convierte en un abrasivo excelente y le permite mantener su pulido y lustre extremadamente bien. No se conocen sustancias naturales que puedan rayar, o cortar, un diamante.
El mercado para los diamantes de grado industrial opera de un modo muy diferente a su contraparte de grado gema. Los diamantes industriales son valuados principalmente por su dureza y conductividad térmica, haciendo muchas de las características gemología gemológicas del diamante, incluyendo claridad y color, principalmente irrelevantes. Esto ayuda a explicar por qué el 80% de los diamantes minados (aproximadamente igual a 100 millones de quilates, o 20000 kg anuales), inadecuados para uso como gemas y conocidos como bort, son destinados para uso industrial. Además de los diamantes minados, los diamantes sintéticos encontraron aplicaciones industriales casi inmediatamente después de su invención en la década de 1950; otros 400 millones de quilates (80000 kg) de diamantes sintéticos son producidos anualmente para uso industrial—casi cuatro veces la masa de diamantes naturales minados en el mismo período.
El uso industrial dominante de los diamantes es en cortado, perforado (brocas de perforación), abrasión (cortadores con filo de diamante), y pulido. La mayoría de usos del diamante en estas tecnologías no requiere diamantes grandes; en efecto, la mayoría de diamantes que son de calidad de gema pueen encontrar un uso industrial. Los diamantes son insertados en puntas de taladros o hojas de sierras, o dispersadas en un polvo para su uso en lijas y aplicaciones de pulido. Algunas aplicaciones especializadas incluyen uso en laboratorios como contenedores para experimentos de alta presión (ver yunque de diamante), rodamientos de alta performance, y un uso limitado en ventanas especializadas.
Con los avances continuos que se hacen en la producción de diamante sintético, algunas aplicaciones futuras están comenzando a ser factibles. Es objeto de mucha excitación el posible uso del diamante como un semiconductor apto para construir microchips, o el uso del diamante como un disipador en electrónica. Hay esfuerzos de investigación significativos en Japón, Europa, y los Estados Unidos para capitalizar el potencial ofrecido por las propiedades materiales únicas del diamante, combinadas con la calidad incrementada y la cantidad de suministro que cominza a hacerse disponible de parte de los fabricantes de diamantes síntéticos.
Cada átomo de carbono en un diamante está unido covalentemente a otros cuatro átomos de carbono, dispuestos en un tetraedro. Estos tetraedros, juntos, forman una red tridimenional de anillos de carbono de seis miembros (similar al ciclohexano), en la conformación de silla, permitiendo que haya tensión de ángulo de enlace de cero. Esta red estable de enlaces covalentes y anillos hexagonales es la razón de que el diamante sea increíblemente duro.
Grafito
El grafito (denominado así por Abraham Gottlob Werner en 1789, del griego γράφειν (graphein, "dibujar/escribir", por su uso en lápices) es uno de los alótropos más comunes del carbono. A diferencia del diamante, el grafito es un conductor eléctrico, y puede ser usado, por ejemplo, como material en los electrodos de una lámpara de arco eléctrico. El grafito tiene la distinción de ser la forma más estable de carbono a condiciones estándar. En consecuencia, es usado en termoquímica como el estado estándar para definir el calor de formación de los compuestos de carbono.
El grafito es capaz de conducir la electricidad, debido a la deslocalización de los electrones π sobre y debajo de los planos de los átomos de carbono. Estos electrones tienen libertad de movimiento, por lo que son capaces de conducir la electricidad. Sin embargo, la electricidad es conducida sólo a los largo del plano de las capas. En el diamante, los cuatro electrones externos de cada átomo de carbono están 'localizados' entre los átomos en enlaces covalentes. El movimiento de los electrones está restringido, y el diamante no conduce corriente eléctrica. En el grafito, cada átomo de carbono usa sólo 3 de sus 4 electrones de los niveles de energía externos en enlaces covalentes a otros tres átomos de carbono en un plano. Cada átomo de carbono contribuye con un electrón a un sistema deslocalizado que es parte también del enlace químico. Los electrones deslocalizados son libres de moverse a través del plano. Por esta razón, el grafito conduce la electricidad a lo largo de los planos de los átomos de carbono, pero no conduce en una dirección a ángulos rectos al plano.
El polvo de grafito es usado como un lubricante seco. Aunque puede pensarse que esta importante propiedad industrial es debida netamente al débil acoplamiento interlaminar entre las hojas en la estructura, en efecto, en un ambiente vacío (como en las tecnologías pasa uso en el espacio), el grafito resultó ser un lubricante muy pobre. Este hecho conduce al descubrimiento de que la lubricidad es debida al aire y agua adsorbidos entre las capas, a diferencia de otros lubricantes secos laminares, como el disulfuro de molibdeno. Estudios recientes sugieren que un efecto denominado superlubricidad puede también explicar este efecto.
Cuando un gran número de defectos cristalográficos unen estos planos ntre sí, el grafito pierde sus propiedades lubricantes y se convierte en lo que es conocido como carbono pirolítico, un material muy útil en implantes que contactan sangre, tales como las válvulas cardíacas prostéticas.
Los grafitos naturales y cristalinos no son usados frecuentemente en forma pura como materiales estructurales, debido a sus planos irregulares, fragilidad y propiedades mecánicas inconsistentes.
En sus formas sintéticas vítreas puras (isotrópicas), el grafito pirolítico y la fibra de carbono, el grafito es un material extremadamente fuerte, resistente al calor (hasta 3000°C), usado en escudos térmicos para las narices de los misiles, motores de cohetes sólidos, reactores de alta temperatura, zapatas de freno, y escobillas de motores eléctricos.
Los grafitos intumescentes o expandibles son usados en sellos de fuego, ajustados alrededor del perímetro de una puerta de fuego. Durante un fuego, el grafito se entumece (expande y calcina) para resistir la penetración del fuego y evitar la difusión de los humos. Una temperatura típica de expansión inicial (SET) está entre 150 y 300 grados Celsius.
Densidad: su gravedad espcífica es 2,3, lo que lo hace más ligero que el diamante.
Efecto dl calor: es el alótropo más estable del carbono. A una temperatura de 2500 grados Celsius, puede ser transformado en diamante. A cerca de 700 grados Celsius, arde en oxígeno puro formando dióxido de carbono.
Actividad química: es ligeramente más reactivo que el diamante. Esto es debido a que los reactantes son capaces de penetrar entre las capas hexagonales de átomos de carbono en el grafito. No es afectado por solventes ordinarios, ácidos diluidos, o álcalis fundidos. Sin embargo, el ácido crómico lo oxida a dióxido de carbono.
Grafeno
Una sola capa de grafito, que alguna vez se creyó ser imposible, es denominada grafeno y tiene propiedades eléctricas, térmicas y físicas extraordinarias. Puede ser producido por epitaxia (deposición química de vapor) en una superficie aislante, o por exfoliación mecánica (pelado repetido). Sus aplicaciones pueden incluir reemplazar al silicio en dispositivos electrónicos de alto rendimiento.
Carbono amorfo
El carbono amorfo es el nombre usado para el carbono que no tiene una estructura cristalina. Como con todos los materiales vítreos, puede presentarse algún orden de corto alcance, pero no hay patrones de largo alcance de las posiciones atómicas.
Aunque que puede fabricarse carbono completamente amorfo, el carbono amorfo natural (como el hollín) realmente contiene cristales microscópicos de grafito,[1] algunas veces diamante.[2] A escala macroscópica, el carbono amorfo no tiene una estructura definida, puesto que consiste de pequeños cristales irregulares, pero a escala nanomicroscópica, puede verse que está hecho de átomos de carbono colocados regularmente
El carbón y el hollín o negro de carbón son llamados informalmente carbono amorfo. Sin embargo, son productos de la pirólisis, que no produce carbono amorfo verdadero bajo condiciones normales. La industria del carbón divide al carbón en varios grados, dependiendo de la cantidad de carbono presente en la muestra, comparada con la cantidad de impurezas. El grado más alto, antracita, es aproximadamente 90 por ciento carbono y 10% otros elementos. El carbón bituminoso es aproximadamente 75-90% carbono, y el lignito es el nombre del carbón que tiene alrededor de 55 por ciento de carbono.
Buckminsterfulerenos
Los buckminsterfulerenos, o usualmente abreviados como fulerenos, fueron descubiertos en 1985 por un equipo de científicos de la Rice University y la University of Sussex, tres de ellos fueron galardonados con el Premio Nóbel de Química de 1996. Recibieron el nombre por la similitud de su estructura alotrópica con las estructuras geodésicas diseñadas por el científico y arquitecto Richard Buckminster "Bucky" Fuller. Los fulerenos son moléculas de tamaños variados, compuestas en su totalidad de carbono, que toman la forman de una esfera hueca, elipsoide, o tubo.
A principios del siglo veintiuno, las propiedades químicas y físicas de los fulerenos son aún objeto de estudio profundo, tanto en laboratorios de investigación pura y aplicada. En abril del 2003, los fulerenos fueron objeto de estudio por su potencial uso médico - al unir a antibióticos específicos a la estructura para apuntar a bacterias resistentes e incluso apuntar a ciertas células de cáncer, tales como el melanoma.
Buckybolas
Fulerenos esféricos son conocidos popularmente como buckybolas, y tienen la fórmula C60.[3]
Nanotubos de carbono
Los nanotubos de carbono, también llamados buckytubos, son moléculas de carbono cilíndricas con propiedades novedosas que las hacen potencialmente muy útiles en una amplia variedad de aplicaciones (nanoelectrónica, óptica, aplicaciones de materiales, etc.). Exhiben propiedades extraordinarias de resistencia, propiedades eléctricas únicas, y son eficientes conductores del calor. También han sido sintetizados nanotubos inorgánicos. Los nanotubos poseen una forma cilíndrica, generalmente con un extremo tapado con un hemisferio de una estructura de buckybola. Su nombre deriva de su tamaño, puesto que el diámetro de un nanotubo es del orden de unos pocos nanómetros (aproximadamente 50 mil veces más delgado que el grosor de un cabello humano), a la vez que pueden ser de algunos centímetros de longitud. Hay dos tipos principales de nanotubos: nanotubo de una sola pared (SWNT) y nanotubo de paredes múltiples (MWNT).
Nanobuds de carbono
Los nanobuds de carbono son un alótropo de carbono recientemente descubiertos, en los que un fulereno, como "compañero", está unidos covalentemente a las paredes laterales externas de un nanotubo de carbono. Este material híbrido tiene propiedades útiles, tanto de los fulerenos como de los nanotubos de carbono. En particular, se ha encontrado que son excepcionales emisores de campo.
Carbono vítreo
El carbono vítreo es una clase de carbono no grafitizante, que es usado ampliamente como material para electrodos en electroquímica, así como en crisoles de alta temperatura, y como componente de algunos dispositivos prostéticos. Fue producido por trabajadores en los laboratorios de The General Electric Company, UK, a inicios de la década de 1960, usando celulosa como material inicial. Poco tiempo después, trabajadores japoneses produjeron un material similar a partir de resinas fenólicas. Fue producido por primera vez por Bernard Redfern a mediados de 1950, en los laboratorios de The Carborundum Company, en UK. Consiguió desarrollar una matriz de polímero para imitar una estructura de diamante, y descubrió una resina fenólica que, con preparación especial, la produciría sin ayuda de un catalizador. Se llenaron algunas patentes, algunas de las cuales fueron retiradas en el interés de la seguridad nacional. Las muestras de investigación originales de la resina y el producto aún existen.
La preparación de carbono vítreo implica someter a los precursores orgánicos a una serie de tratamientos térmicos a temperaturas hasta de 3000°C. A diferencia de muchos carbonos no grafitizantes, son impermeables a los gases, y son extremadamente inertes químicamente, especialmente aquellos preparados a muy altas temperaturas. Se ha demostrado que las velocidades de oxidación de ciertos carbonos vítreos en oxígeno, dióxido de carbono, o vapor de agua, son menores que las de cualquier otro carbono. También son altamente resistentes al ataque por ácidos. En consecuencia, mientras el grafito normal es reducido a un polvo por una mezcla de ácido sulfúrico y ácido nítrico a temperatura ambiente, el carbono vítreo no es afectado por tal tratamiento, incluso después de varios meses.
Nanoespuma de carbono
La nanoespuma de carbono es el quinto alótropo conocido del carbono, descubierto en 1997 por Andrei V. Rode y colaboradores en la Australian National University en Canberra. Consiste de un ensamblado de cúmulos de baja densidad de átomos de carbono, mantenidos en una red tridimensional difusa.
Cada cúmulo es de aproximadamente 6 nm de ancho, y consiste de aproximadamente 4000 átomos de carbono, unidos en hojas similares a las del grafito, que tienen una curvatura negativa por la inclusión de heptágonos en el esquema regular hexagonal. Esto es el opuesto de lo que pasa en el caso de los buckminsterfulerenos, en el que las hojas de carbono reciben una curvatura positiva por la inclusión de pentágonos.
La estructura a gran escala de la nanoespuma de carbono es similar a la de un aerogel, pero con el 1% de la densidad de los aerogeles de carbono anteriormente producidos - sólo unas pocas veces más la densidad del aire a nivel del mar. A diferencia de los aerogeles de carbono, la nanoespuma de carbono es un mal conductor eléctrico.
Lonsdaleíta (diamante hexagonal)
La lonsdaleíta es un alótropo hexagonal del alótropo de carbono diamante, que se cree se forma a partir del grafito presente en los meteoritos al impactar sobre la Tierra. El gran calor y tensión del impacto transforman el grafito en diamante, pero reteniendo la estructura cristalina hexagonal del grafito. El diamante hexagonal ha sido sintetizado en el laboratorio, mediante compresión y calentamiento del grafito, tanto mediante el uso de una prensa estática, o usando explosivos.
Carbono acetilénico lineal (LAC)
Variabilidad del carbono
El sistema de alótropos del carbono se extiende en un rango sorprendente de extremos, considerando que son sólo formaciones estructurales del mismo elemento.
Entre el diamante y el grafito:
- El diamante cristaliza en el sistema cúbico, pero el grafito cristaliza en el sistema hexagonal.
- El diamante es el mineral natural más duro conocido (10 en la escala de Mohs), pero el grafito es uno de los más suaves (1-2 en la escala de Mohs).
- El diamante es el abrasivo extremo, mientras que el grafito es un muy buen lubricante.
- El diamante es un excelente aislante eléctrico, mientras que el grafito es un conductor de la electricidad.
- El diamante es un excelente conductor térmico, mientras que algunas formas de grafito son usadas para aislamiento térmico (por ejemplo, en escudos térmicos y cortafuegos).
Otras formas posibles
- La caoíta es un mineral que se cree que puede haber formado en impactos de meteoritos. Ha sido descrito como ligeramente más duro que el grafito, con un color de reflexión de gris a blanco. Sin embargo, la existencia de fases carbino está en disputa - véase la entrada de caoíta para más detalles.
- El carbono metálico: estudios teóricos han mostrado que el carbono (diamante), cuando es sometido a presiones enormes, aparecen regiones en el diagrama de fases donde tiene un carácter metálico.[4] Parece que puede ser superconductor a temperaturas muy bajas (4 K).[5]
- A presiones ultraaltas, por encima de los 1000 GPa, se ha predicho que el diamante se transforma en la estructura bc8, una estructura cúbica centrada en el cuerpo, con 8 átomos en la celda unitaria. Esta fase podría tener importancia en astrofísica. Su estructura es conocida en una de las fases metaestables del silicio.[cita requerida]
- La hexagonita: en teoría, en vez de tener anillos de 6 átomos de grafito, un átomo sp podría insertarse entre cad uno de los 6 átomos sp2 atoms.[6]
- Prismano C8 es otra posible forma metaestable.
Referencias
- ↑ Randall L. Vander Wal Soot Precursor Material: Spatial Location via Simultaneous LIF-LII Imaging and Characterization via TEM: NASA Contractor Report 198469 (1996)
- ↑ IUPAC Compendium of Chemical Terminology 2nd Edition (1997) diamond-like carbon films
- ↑ http://www.3rd1000.com/bucky/bucky.htm
- ↑ Carbon under extreme conditions: Phase boundaries and electronic properties from first-principles theory
- ↑ Superconducting diamond turns up in Russia - physicsworld.com
- ↑ http://www.hexagonite.com/hexagoniteII.pdf
Enlaces externos
- http://www.dendritics.com/scales/c-allotropes.asp
- http://cst-www.nrl.navy.mil/lattice/struk/carbon.html
- diamond 3D animation
Categoría: Carbono
Wikimedia foundation. 2010.


