- Adsorción
-
La adsorción es un proceso por el cual átomos, iones o moléculas son atrapadas o retenidas
- Adsorción química. El adsorbato forma enlaces fuertes en los centros activos del adsorbente.
Contenido
Termodinámica de la adsorción[1]
La adsorción es el proceso mediante el cual un sólido poroso (a nivel microscópico) es capaz de retener partículas de un fluido en su superficie tras entrar en contacto con éste.
 Nanoporos en una muestra de carbón activo vista al microscopio electrónico.
Nanoporos en una muestra de carbón activo vista al microscopio electrónico.
El adsorbente dispone de nanoporos, lo que se conoce como centros activos, en los que las fuerzas de enlace entre los átomos no están saturadas. Estos centros activos admiten que se instalen moléculas de naturaleza distinta a la suya, procedentes de un gas en contacto con su superficie. La adsorción es un proceso exotérmico y se produce por tanto de manera espontánea si el adsorbente no se encuentra saturado.
La aplicación más importante de la termodinámica de la adsorción es la de calcular los equilibrios de fase entre un sólido adsorbente y una mezcla gaseosa. En este desarrollo, por simplicidad, sólo tomaremos en consideración gases puros (monocomponentes).
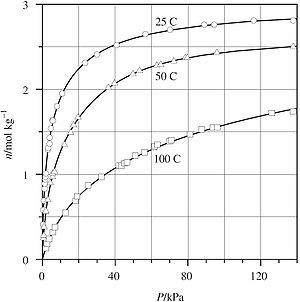
La base de todo este cálculo son las isotermas de adsorción, las cuales dan la cantidad de gas adsorbido en los nanoporos como una función de la presión externa (del gas). La termodinámica sólo puede aplicarse a las isotermas de adsorción en el equilibrio. Esto significa que se debe poder llegar a cualquier punto de la curva elevando o disminuyendo la presión; en otras palabras, las curvas de adsorción y desorción tienen que coincidir. Esto ocurre sólo si no existe histéresis. La histéresis no se da en poros menores de 2 nm, sin embargo, se observa en poros lo suficientemente grandes como para que en su interior se condense gas para formar líquido.
La isoterma de adsorción para un gas puro es la relación entre la cantidad adsorbida específica n (moles de gas por kilogramo de sólido) y P, la presión exterior de la fase gaseosa. La mayor parte de isotermas se pueden ajustar mediante una ecuación del virial modificada:
![P(n)=\frac{n}{K}\left[\frac{m}{m-n}\right]e^{[C_1n+C_2n^2+C_3n^3+...]} \qquad para \qquad n<m \qquad (1)](8/8680bc0b162f9921d96f8864277a64b4.png)
donde K es la constante de Henry (el valor de la isoterma de adsorción dn/dP cuando la presión tiende a cero), m la capacidad de saturación del medio sólido (mol kg-1) y Ci son los coeficientes del virial. Normalmente tres coeficientes bastan para ajustar la curva a los datos experimentales.
Nótese que las isotermas han de obtenerse a partir de la interpolación de datos experimentales, aunque existen también modelos moleculares, al margen de la termodinámica, de los que se pueden obtener teóricamente las propiedades del sistema. La interpolación de las isotermas de adsorción respecto de la temperatura se basa en la ecuación
![\bar h = R \left[ \frac{\partial \ln P}{\partial (1/T)} \right]_n \qquad (2)](d/18deff240e12e7b7c59f9bcb1e4ded60.png)
donde
 es la entalpía de adsorción diferencial, negativa porque la adsorción es un proceso exotérmico, como ya hemos comentado. El valor absoluto de
es la entalpía de adsorción diferencial, negativa porque la adsorción es un proceso exotérmico, como ya hemos comentado. El valor absoluto de  se denomina "calor isostérico".
se denomina "calor isostérico".Normalmente la entalpía diferencial se calcula a partir de la ecuación (2) haciendo uso de dos o más isotermas de adsorción. El gran potencial desempeña un papel fundamental en la termodinámica de la adsorción. Se define como

donde F es la energía libre de Helmholtz. Las variables independientes son temperatura, volumen y potencial químico. Para adsorción en un gas puro, el gran potencial se obtiene a partir de la integración de una isoterma:
![\Omega = - RT \int_0^R \frac{n}{P} dP = - RT \int_0^n \left[ \frac{\partial ln P}{\partial n} \right]_T dn \qquad (4)](0/460c28d0717641507645916acbf6883c.png)
Ω se expresa en J kg-1 de adsorbente sólido. El significado físico del gran potencial es la variación de energía libre asociada a la inmersión isotérmica del adsorbente 'virgen' en el volumen del gas.
La entalpía de inmersión H es la integral de la entalpía diferencial:

Al igual que Ω, tiene unidades de J kg-1.
Una vez obtenidas la energía de inmersión (Ω) y la entalpía de inmersión (H), la entropía de inmersión es:

A partir de estas ecuaciones se puede hacer todo el análisis termodinámico en un sistema formado por un adsorbente y un gas. No debemos dejar de tener en cuenta que la determinación de la ecuación (1), de donde hemos derivado todas las demás, se hace a partir de mediciones experimentales.
Fisisorción
La fisisorción es la forma más simple de adsorción, y es debida a débiles fuerzas atractivas, generalmente fuerzas de Van der Waals (véase fuerzas dispersivas). Dado que estas fuerzas son omnipresentes, resulta que rápidamente cualquier superficie limpia expuesta al ambiente acumula una capa de material fisisorbido.
Quimisorción
La quimisorción ocurre cuando un enlace químico, definido en este caso como un intercambio de electrones, se forma. El grado de intercambio y lo simétrico que sea dependen de los materiales involucrados. A menudo hay un paralelismo con las situaciones encontradas en química de coordinación. La quimisorción es particularmente importante en la catálisis heterogénea, la forma más común en la industria, donde un catalizador sólido interacciona con un flujo gaseoso, el reactivo o los reactivos, en lo que se denomina reacción en lecho fluido. La adsorción del reactivo por la superficie del catalizador crea un enlace químico, alterando la densidad electrónica alrededor de la molécula reactivo y permitiendo reacciones que normalmente no se producirían en otras circunstancias. La corrosión es un ejemplo de ello.
Aplicaciones
Una de las aplicaciones más conocidas de la adsorción en el mundo industrial, es la extracción de humedad del aire comprimido.
Se consigue haciendo pasar el aire comprimido a través de un lecho de alúmina activa u otros materiales con efecto de adsorción a la molécula de agua.
La saturación del lecho se consigue sometiendo a presión el gas o aire, así la molécula de agua es adsorbida por la molécula del lecho, hasta su saturación.
La regeneración del lecho, se consigue soltando al exterior este aire comprimido y haciendo pasar una corriente de aire presecado a través del lecho.
Lo habitual es encontrar secadores de adsorción en forma de dos columnas y mientras una adsorbe, la otra es regenerada por el mismo aire seco de la columna anterior. Este sistema se conoce como "pressure swing" o PSA.
Otras aplicaciones en las que se emplea éste proceso de adsorción como separación son: purificación de agua, tratamiento de aguas residuales, quitar olores, sabores o colores no deseados por ejemplo en aceites, jarabes de azúcar, en la deshumidificación de gasolinas, o en el secado de aire.
La otra aplicación más extendida es la obtención de nitrógeno, haciendo pasar un caudal de aire comprimido por el lecho adsorvente, compuesto por carbón molécular, especialmente manufacturado para ese propósito.Usa el mismo sistema ya mencionado de "pressure swing", de los secadores de adsorción. Una cámara llena de carbón es sometida a presión con aire comprimido, la molécula de Oxigeno, es retenida por el nanoporo del carbón, mientras que la molécula de Nitrógeno, de más tamaño, no consigue entrar en el nanoporo del adsorbente. Se consegui así, disponer de gran cantidad de nitrogeno después del lecho adsorvente y el oxigeno, queda retenido. En la segunda parte del ciclo, con la despresurización, el oxigeno se libera del nanoporo y se evacua a la atmósfera.
Los generadores de nitrogeno, usan este sistema y sus aplicaciones se han generalizado en la industria, en usos como la inertización de depósitos, de envases de productos alimenticios o farmacéuticos y en laboratorios, donde se usa el nitrógeno como gas portador o inertización de cámaras.
Véase también
Referencias
- ↑ Alan L. Myers, Thermodynamics of Adsorption. Perteneciente a la publicación Chemical Thermodynamics for Industry - Ed. T.M. Letcher, 2004
Categorías:- Química de superficies
- Química coloidal
- Procesos termodinámicos
- Catálisis
Wikimedia foundation. 2010.