- Fullereno
-
Los fullerenos (a veces escrito fulerenos) son la tercera forma más estable del carbono, tras el diamante y el grafito. El primer fullereno se descubrió en 1985 y se han vuelto populares entre los químicos, tanto por su belleza estructural como por su versatilidad para la síntesis de nuevos compuestos, ya que se presentan en forma de esferas, elipsoides o cilindros. Los fullerenos esféricos reciben a menudo el nombre de buckyesferas y los cilíndricos el de buckytubos o nanotubos. Reciben este nombre de Buckminster Fuller, que empleó con éxito la cúpula geodésica en la arquitectura.
Contenido
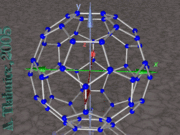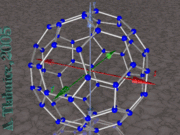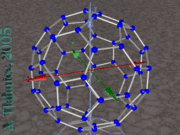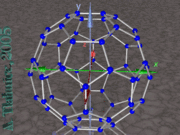
El Buckminsterfullereno o fullereno de C60
El fullereno más conocido es el buckminsterfullereno. Se trata de un fullereno formado por 60 átomos de carbono (C60), en el que ninguno de los pentágonos que lo componen comparten un borde; si los pentágonos tienen una arista en común, la estructura estará desestabilizada (véase pentaleno). La estructura de C60 es la de una figura geométrica truncada y se asemeja a un balón de fútbol (domo geodésico), constituido por 20 hexágonos y 12 pentágonos, con un átomo de carbono en cada una de las esquinas de los hexágonos y un enlace a lo largo de cada arista. El nombre de buckminsterfullereno viene de Richard Buckminster Fuller con motivo a una similitud de la molécula con una de las construcciones del mencionado arquitecto.
Otros fullerenos
El fullereno C20 es el más pequeño de todos, no tiene hexágonos, sólo 12 pentágonos, mientras que el C70, tiene 12 pentágonos al igual que el buckminsterfullereno, pero tiene más hexágonos, y su forma en este caso se asemeja un balón de rugby. Un nanotubo es una sustancia integrada por fullerenos polimerizados, en los que los átomos de carbono a partir de un determinado punto enlazan con los átomos de carbono de otro fullereno.
Los fullerenos cilíndricos pueden formar estructuras más complejas, asociándose entre sí y formando nanotubos.
La predicción y el descubrimiento
Hasta el siglo XX, el grafito y el diamante eran las únicas formas alotrópicas conocidos del carbono. En experimentos de espectroscopía molecular, se observaron picos que correspondían a moléculas con una masa molecular exacta de 60, 70 o más átomos de carbono. Harold Kroto, de la Universidad de Sussex, James Heath, Sean O'Brien, Robert Curl y Richard Smalley, de la Universidad de Rice, descubrieron el C60 y otros fullerenos en 1985, en un experimento que consistió en hacer incidir un rayo láser sobre un trozo de grafito. Ellos esperaban efectivamente descubrir nuevos alótropos del carbono, pero suponían que serían moléculas largas, en lugar de las formas esféricas y cilíndricas que encontraron. A Kroto, Curl y a Smalley se le concedió el premio Nobel de Química en 1996, por su colaboración en el descubrimiento de esta clase de compuestos. El C60 y otros fullerenos fueron más adelante observados fuera del laboratorio (ej. en el hollín de una vela). Hacia el año 1991, era relativamente fácil producir unos cuantos gramos de polvo de fullereno usando las técnicas de Donald Huffman y Wolfgang Krätschmer. La purificación del fullereno era un desafío para los químicos hasta hace poco cuando un equipo de investigadores españoles desarrolló un nuevo proceso de obtención.[1] Los fullerenos endoédricos han incorporado, entre los átomos de la red, iones u otras moléculas más pequeñas. El fullereno es un reactivo habitual en muchas reacciones orgánicas como por ejemplo en la reacción de Bingel, descubierta en 1993.
Fullerenos en el espacio
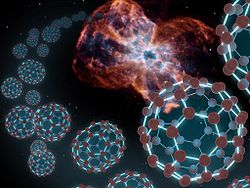 Fulerenos. La imagen muestra una concepción artística, que ilustra las bolas de carbono despedidas de una nebulosa planetaria. Las imágenes de Tc1 no son muy buenas, por consiguiente una foto de la nebulosa NGC 2440 (tomada con el telescopio Hubble) fue usada en esta concepción artística.[2]
Fulerenos. La imagen muestra una concepción artística, que ilustra las bolas de carbono despedidas de una nebulosa planetaria. Las imágenes de Tc1 no son muy buenas, por consiguiente una foto de la nebulosa NGC 2440 (tomada con el telescopio Hubble) fue usada en esta concepción artística.[2]
En Julio del 2010 la NASA anunció que finalmente se descubrieron fullerenos en el espacio. Al usar la visión infrarroja sensible del telescopio Spitzer, los investigadores han confirmado la presencia de C70 en la nebulosa planetaria Tc1. Los astrónomos creen que los fullerenos son creados en las capas exteriores de una estrella, como nuestro sol, y posteriormente son expulsadas al espacio después de la explosión de las mismas.[2]
Propiedades
A comienzos del siglo XXI, las propiedades químicas y físicas de fullerenos todavía están bajo intenso estudio, en laboratorios de investigación pura y aplicada. En abril de 2003, se estaba estudiando el potencial uso medicinal de los fullerenos, fijando antibióticos espécificos en su estructura para atacar bacterias resistentes y ciertas células cancerígenas, tales como el melanoma.
Los fullerenos no son muy reactivos debido a la estabilidad de los enlaces tipo grafito, y son también muy poco solubles en la mayoría de disolventes. Entre los disolventes comunes para los fullerenos se incluyen el tolueno y el disulfuro de carbono. Las disoluciones de buckminsterfullereno puro tienen un color púrpura intenso. El fullereno es la única forma alotrópica del carbono que puede ser disuelta. Los investigadores han podido aumentar su reactividad uniendo grupos activos a las superficies de los fullerenos. El buckminsterfullereno no presenta "superaromaticidad", es decir, los electrones de los anillos hexagonales no pueden deslocalizar en la molécula entera.
Se pueden atrapar otros átomos dentro de los fullerenos; de hecho existen evidencias de ello gracias al análisis del gas noble conservado en estas condiciones tras el impacto de un meteorito a finales del periodo Pérmico. En el campo de la nanotecnología, la resistencia térmica y la superconductividad son algunas de las características más profundamente estudiadas.
Un método habitual para producir fullerenos es hacer pasar una corriente eléctrica intensa entre dos electrodos de grafito próximos en atmósfera inerte. El arco resultante entre los dos electrodos produce un depósito de hollín del que se pueden aislar muchos fullerenos diferentes.
Posibles riesgos
Aunque se piensa que las buckyesferas son en teoría relativamente inertes, una presentación dada a la Sociedad Química Estadounidense en marzo de 2004 y descrita en un artículo publicado en la revista New Scientist el 3 de abril de 2004, sugiere que la molécula es perjudicial para los organismos. Un experimento llevado a cabo por Eva Oberdörster en la Southern Methodist University, en el que introdujo fullerenos en agua en concentraciones de 0,5 partes por millón, mostró que un pez (Micropterus_salmoides) "Black Bass" sufrió un daño celular en el tejido cerebral 17 veces superior, 48 horas después. El daño consistía en una peroxidación lipídica a nivel de la membrana celular, lo que deteriora el funcionamiento de ésta. Se produjeron también inflamaciones en el hígado y la activación de genes relacionados con la síntesis de enzimas reparadoras.
Solubilidad
La siguiente lista muestra los disolventes en orden decreciente de solubilidad para una mezcla de C60/C70). Los valores entre paréntesis indican la concentración de saturación.
- 1,2,4-triclorobenceno (20 mg/ml)
- disulfuro de carbono (12 mg/ml)
- tolueno (3,2 mg/ml)
- benceno (1,8 mg/ml)
- cloroformo (0,5 mg/ml)
- tetracloruro de carbono (0,4 mg/ml)
- ciclohexano (0,054 mg/ml)
- n-hexano (0,046 mg/ml)
- tetrahidrofurano (0,037 mg/ml)
- acetonitrilo (0,02 mg/ml)
- metanol (0,0009 mg/ml)
Matemáticas de los fullerenos
En términos matemáticos, la estructura de un fullereno es un poliedro convexo con caras pentagonales y hexagonales.
Con ayuda de la fórmula de Euler : caras + Vértices - aristas = 2, además del hecho de que cada vértice en una estructura de fullereno pertenece exactamente a tres caras, se puede demostrar fácilmente que en un fullereno hay exactamente 12 pentágonos. El fullereno más pequeño es el C20, el dodecaedro. No existen fullerenos con 22 vértices. El número de fullerenos C2n diferentes crece de manera muy rápida al aumentar el valor de n; por ejemplo, hay 1.812 fullerenos C60, pero sólo uno de ellos, el buckminsterfullereno, no tiene pentágonos adyacentes.
Lecturas para profundizar
- The Most Beautiful Molecule: The Discovery of the Buckyball by Hugh Aldersey-Williams (John Wiley & Sons, 1995) ISBN 0-471-19333-X
Véase también
Referencias
- ↑ «Fullerenes from aromatic precursors by surface-catalysed cyclodehydrogenation : Abstract : Nature».
- ↑ a b NASA, 2010. Spitzer: studying the universe in infrared. http://www.nasa.gov/mission_pages/spitzer/news/spitzer20100722.html
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre FullerenoCommons.
Wikimedia Commons alberga contenido multimedia sobre FullerenoCommons.- Una Galeria de fullerenos y nanotubos
- Detectan moléculas gigantes en el espacio [1]
- Divulgación sobre ciencia y tecnología de los materiales de carbón, grafito diamante, fullerenos, nanotubos de carbón, etc.
- Página personal sobre el tema
- Google homenajea los 25 años del Buckminsterfullereno
- Center for Nanoscale Science and Technology
- Dr. Smalley's brief autobiography
- Dr. Smalley's webpage
- Potential use of fullerenes in medicine
- Carbon Fullerene & Nanotube Models Vincent Herr, Houston, TX
- Fullerene Images for Web and Presentation
- Discovery of graphene
- Diffraction and Interference with Fullerenes: Wave-particle duality of C60, University of Vienna
- Fullerene-based architectures for quantum computing in Germany and in Great Britain at the QIP IRC
- Computational Chemistry Wiki
- Fullereno de C60 en nanocristales
- El Elemento 60
Categorías:- Química inorgánica
- Química orgánica
- Alótropos
- Carbono
- Nanotecnología
- Materiales superconductores
- Materiales superduros
Wikimedia foundation. 2010.