- Metionina
-
Metionina
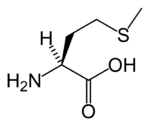
Nombre (IUPAC) sistemático Ácido 2-amino-4-metiltiobutanoico General Símbolo Met, M Fórmula molecular C5H11NO2S Identificadores Número CAS 63-68-3 PubChem Propiedades físicas Densidad 1340 kg/m3; 1,34 g/cm3 Masa molar 149,21 g/mol Punto de fusión 554 K (280,85 °C) Propiedades químicas Acidez (pKa) 2,16; 9,08 Solubilidad en agua soluble Bioquímica Familia Aminoácido Esencial Sí Codón AUG Punto isoeléctrico (pH) 5,74 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasLa metionina ( abreviada como Met o M) es un α-aminóacido con la fórmula química HO2CCH(NH2)CH2CH2SCH3. Este aminoácido esencial está clasificado como no polar.
Contenido
Función
Junto a la cisteína, la metionina es uno de los dos aminoácidos proteinogénicos que contienen azufre. Este deriva del adenosil metionina (SAM) sirviendo como donante de metiles. La metionina es un intermediario en la biosíntesis de la cisteína, la carnitina, la taurina, la lecitina, la fosfatidilcolina y otros fosfolípidos. Fallos en la conversión de metionina pueden desembocar en ateroesclerosis.
Este aminoácido es usado también por las plantas en la síntesis del etileno. Este proceso es conocido como el ciclo de Yang o el ciclo de la metionina. La metionina es uno de los dos aminoácidos codificados por un único codón (AUG) del código genético. (el otro es el triptófano que está codificado por UGG). El codón AUG es también el inicio del mensaje para el ribosoma que indica la iniciación de la traducción de una proteína desde el ARNm. Como consecuencia la metionina es incorporada en la posición de la archea durante la traducción, a pesar de que suele ser eliminada en las modificaciones postraduccionales.
Biosíntesis
 Resumen metabólico de la metionina
Resumen metabólico de la metionina
Enzimas:
- EC 2.1.1.- Metil Transferasas SAM dependientes
- EC 2.1.1.5 Betaina-homocisteína S-metiltransferasa
- EC 2.1.1.13 Metionina sintasa
- EC 2.3.1.30 Serina acetiltransferasa
- EC 2.3.1.46 Homoserina O-succiniltransferasa
- EC 2.5.1.6 Metionina adenosiltransferasa
- EC 2.5.1.47 Cisteína sintasa
- EC 2.5.1.48 Cistationina γ-sintasa
- EC 3.3.1.1 S-Adenosilhomocisteína hidrolasa
- EC 4.1.1.57 Metionina descarboxilasa
- EC 4.2.1.22 Cistationina-β-sintasa
- EC 4.4.1.1 Cistationina γ -liasa
- EC 4.4.1.8 Cistationina-β-liasa
Como aminoácido esencial la metionina no es sintetizada en los humanos, por lo tanto hemos de ingerir metionina o proteínas que la contengan. En las plantas y los microorganismos, la metionina es sintetizada por una vía que utiliza tanto ácido aspártico como cisteína. Primero, el ácido aspártico se convierte, via la β-aspartilo-semialdehído, en homoserina, introduciendo un par de grupos metilenos contiguos. La homoserina pasa a convertirse en 0-succinilhomoserina que tras esto reacciona con la cisterna para producir cistationina que es clave para dar paso a la homocisteína. Posteriormente va la metilación del grupo tiol a partir de fosfatos lo que forma la metionina. Tanto la cistationina-γ-sintetasa y la cistationina-β-sintetasa requieren Piridoxil-5’-fosfato como cofactor, mientras que la metiltransferasa homocisteína requiere de Vitamina B12 como cofactor.
Las enzimas que participan en la biosíntesis de la metionina son:
- Aspartokinasa
- β-aspartato semialdehído deshidrogenasa
- homoserina dehidrogenasa
- homoserina acetiltransferasa
- cistationina-γ-sintetasa
- cistationina-β-liasa
- metionina sintetasa(en mamíferos, este paso es efectuada por la homocisteína metiltransferasa)
Otras vías biomédicas
A pesar de que los mamíferos no pueden sintetizar metionina, aun así todavía se puede utilizar en una gran variedad de vías biomédicas:
Generación de la homocisteína
La metionina es convertida a S-adenosilmetionina (SAM) por la metionina adenosiltransferasa. SAM sirve como donante de metiles en muchas reacciones de transferencia de metilos y es convertido en S-adenosilhomocisteína (SAH).
La adenocilhomocisteínasa convierte el SAH a homocisteína. Hay dos destinos de la homocisteína, puede ser la regeneración de la metionina o para formar cisteína.
Regeneración de la metionina
La metionina puede ser regenerada a través de la vía de la homocisteína, participando la metionina sintetasa.
También puede ser remetilado usando la betaina glicina (NNN-trimetil glicina) a través de la vía de la metionina en la que la enzima beatina-homocisteína metiltransferasa (E.C.2.1.1.5, BHMT). La BHMT representa un 1.5% de todas las proteínas solubles en el hígado y evidencias recientes sugieren que puede tener una gran influencia en la homeostasis de la emtionina y la homocisteína aún mayor que la metionina sintetasa.
Conversión a cisteína
La homocisteína puede ser convertida a cisteína. 1. La cistationina-beta-sintetasa (una enzima dependiente del PLP) combina homocisteína y serina para producir cistationina. En vez de degradar cistationina via cistationina-beta-liasa, característica esta degradación de la biosíntesis, en este caso la cistationina es rota pasando a cisteína y en la α-ketobutirato produciendo cistationina-Y-liasa. 2. La alfa-ketoácido deshidrogenada convierte alfa-ketobutirato en propionilo-CoA que es metabolizado a propionil-CoA en un proceso de tres pasos.
Biosíntesis de poliaminas
Las poliaminas espermina y espermidina requieren la transferencia de un sustituyente 3-aminopropil al nitrógeno de una molécula de putrescina o de espermina. Dicho grupo se obtiene por descarboxilación de la S-Adenosil metionina (SAM). Cuando se sintetiza la espermina o la espermidina, el S-metiltiorribósido sufre una serie de transformaciones de tal manera que se recupere la metionina. Dicha ruta se conoce como Ruta de salvamento de la metionina ("Methionine Salvage Pathway")[1]
 Ruta de salvamento de la metionina
Ruta de salvamento de la metionina
Enzimas:
- EC 1.13.11.54 Acirreductona dioxigenasa dependiente de hierro (II).
- EC 1.13.11.53 Acirreductona dioxygenasa dependiente de níquel (II)
- EC 2.5.1.22 Espermina sintasa
- EC 2.6.1.5 Tirosina transaminasa (También puede transaminar metionina)[2]
- EC 2.7.1.100 S-Metil-5-tiorribosa quinasa
- EC 3.1.3.77 Acirreductona sintasa
- EC 3.2.2.16 Metiltioadenosina nucleosidasa
- EC 4.1.1.50 S-Adenosilmetionina descarboxilasa
- EC 4.2.1.109 Metiltiorribulosa 1-fosfato deshidratasa
- EC 5.3.1.23 S-metil-5-tiorribosa-1-fosfato isomerasa
Otras biosíntesis
La metionina está implicada en la biosíntesis de etileno,[3] la nicotianamina,[4] las salinosporamidas[5] y varios glucosinolatos[6] tales como la sinigrina, la glucoqueirolina, la glucoerucina, la glucoiberina, la glucoiberverina, la glucorrafanina y el sulforrafano[7]
Aspectos dietéticos
En las sémillas de sésamo podemos encontrar níveles bastante altos de metionina, al igual que en nueces brasileñas, pescado , carne y otras semillas de plantas. Existen numerosas frutas y vegetales que apenas contienen metionina, sólo en pequeñas cantidades. La mayoría de legumbres, tienen una cantidad muy baja de metionina.
La metionina racémica suele añadirse como ingrediente a la comida para mascotas.
Fuentes alimentarias de metionina[8] Alimento g/100g Semillas de sésamo 1.656 Nueces brasileñas 1.008 Soja concentrada en proteínas 0.814 Avena 0.312 Cacahuetes 0.309 Garbanzo 0.253 Maíz 0.197 Almendra 0.151 Habas pintas cocinadas 0.117 Lentejas 0.077 Arroz Negro, cocinado y de grano mediano 0.052 Restricción en el consumo Metionina
Cada día son más los estudios que muestran que la restricción en el consumo de metionina puede incrementar el período de vida de algunos animales. En 2005, un estudio mostró que la restricción en el consumo de metionina sin restricción de energía en los roedores, aumenta la duración de su vida.
Véase también
- ARN
- Ciclo de la metionina
- Ribosoma
- Síntesis proteica
Referencias
- ↑ Jonathan W. Wray, Robert H. Abeles (1995). «The Methionine Salvage Pathway in Klebsiella pneumoniae and Rat Liver IDENTIFICATION AND CHARACTERIZATION OF TWO NOVEL DIOXYGENASES». The Journal of Biological Chemistry, 270: pp. 3147-3153. doi:.
- ↑ Heilbronn J, Wilson J, Berger BJ. (1999). «Tyrosine aminotransferase catalyzes the final step of methionine recycling in Klebsiella pneumoniae.». J Bacteriol. 181 (6): pp. 1739-47..
- ↑ http://www.enzyme-database.org/reaction/misc/ethene.html
- ↑ http://www.enzyme-database.org/reaction/misc/nicotian.html
- ↑ Yolande A. Chan,Angela M. Podevels,Brian M. Kevanya, Michael G. Thomas (2009). «Biosynthesis of polyketide synthase extender units». Natural Product Reports 26: pp. 103. doi:.
- ↑ http://www.plantphysiol.org/cgi/reprint/86/2/319.pdf
- ↑ Paul M. Dewick (2009). Medicinal natural products: a biosynthetic approach. John Wiley and Sons. ISBN 0470741686, 9780470741689.
- ↑ National Nutrient Database for Standard Reference, U.S. Department of Agriculture, http://www.nal.usda.gov/fnic/foodcomp/search/, consultado el 2009-09-07.
Enlaces externos
http://www.naturesbounty.com/vf/healthnotes/HN77/HN77_Spanish/Es-Supp/Methionine.htm
Categorías:- Aminoácidos
- Aminoácidos esenciales
- Aminoácidos neutros no polares
- Aminoácidos glucogénicos
- Aminoácidos azufrados
Wikimedia foundation. 2010.
