- Nitrilo
-
Los nitrilos son compuestos orgánicos que poseen un grupo ciano (-C≡N) como grupo funcional principal. Son derivados orgánicos del cianuro de hidrógeno H, en los que el hidrógeno ha sido sustituido por un radical alquilo.
Contenido
Estructura química
El grupo ciano presente en los nitrilos está constituído por un carbono con hibridación sp unido covalentemente con un nitrógeno, lo cual le confiere al grupo funcional una estructura lineal.
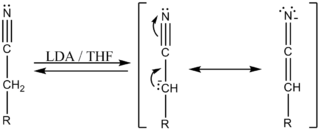
La diferencia entre las electronegatividades del carbono y del nitrógeno polariza el enlace, produciendose una deficiencia electrónica sobre el carbono y un aumento en la densidad electrónica sobre el nitrógeno. Esto determina la reactividad de los nitrilos, participando generalmente en reacciones de adición nucleofílica (AN).[1] ?
Propiedades químicas
Al igual que los compuestos carbonílicos y nitroderivados, en medio fuertemente alcalino puede desprotonar sus hidrógenos localizados en el carbono alfa (en el caso que la estructura lo permita) y estabilizarse por efecto mesomérico, produciendo reacciones de condensación.[1]
Nomenclatura
Los nitrilos, generalmente, son nombrados utilizando el sufijo -nitrilo. En el caso que el grupo funcional ciano no sea el principal del compuesto, se utilizan los prefijos ciano- o cianuro de ... .
C Nombre del compuesto Estructura PM (g/mol) P.Fus. (ºC) P.Eb. (ºC) 1 cianuro de hidrógeno[2] H-C≡N 27,0 -13,24 25,7 2 acetonitrilo o etanonitrilo[3] CH3-C≡N 41,0 -45 81 3 propionitrilo o propanonitrilo[4] CH3-CH2-C≡N 55,1 -92 97 4 butironitrilo o butanonitrilo[5] CH3-CH2-CH2-C≡N 69,1 -112 116-118 5 pentanonitrilo[6] CH3-CH2-CH2-CH2-C≡N 83,1 -96 139 6 hexanonitrilo[7] CH3-CH2-CH2-CH2-CH2-C≡N 97 -80 161-164 7 heptanonitrilo o caprilonitrilo[8] CH3-CH2-CH2-CH2-CH2-CH2-C≡N 111,2 -64 186-187 8 octanonitrilo[9] CH3-CH2-CH2-CH2-CH2-CH2-CH2-C≡N 125,2 -45 198-200 9 nonanonitrilo o pelargononitrilo[10] CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-C≡N 139,2 -35 224 10 decanonitrilo[11] CH3-CH2-CH2-CH2-CH2-CH2-CH2-CH2-CH2-C≡N 153,3 N/D 241-243 Algunos nitrilos reciben nombres especiales:
- Acrilonitrilo CH2=CH-CN
- Malononitrilo NC-CH2-CN
- Piruvonitrilo CH3-CO-CN
Propiedades físicas
El grupo ciano está polarizado de tal forma que el átomo de carbono es el extremo positivo del dipolo y el nitrógeno el negativo. Esta polaridad hace que los nitrilos estén muy asociados en estado líquido. Así, sus puntos de ebullición son algo superiores a los de los alcoholes de masa molecular comparable. Los nitrilos de más de 15 carbonos son sólidos.[12] Exceptuando los primeros de la serie, son sustancias insolubles en agua. La mayoría de los nitrilos tienen un olor que recuerda al del cianuro de hidrógeno y son moderadamente tóxicos.
Obtención
Los nitrilos se obtienen por acción del cianuro de sodio o de potasio sobre los haluros de alquilo, y también calentando las amidas en presencia de un deshidratante.
Reacciones
Una de las reacciones más utilizadas de los nitrilos es su hidrólisis a ácidos carboxílicos. Esta reacción tiene lugar en presencia de un ácido o de una base fuertes, y en ambos casos el primer producto es una amida, que no puede ser aislada a menos que su velocidad de hidrólisis sea inferior a la del nitrilo inicial.
Referencias
- ↑ a b McMurry, John (2004). «Ácidos carboxílicos y nitrilos.». Química Orgánica (sexta edición). Thompson. ISBN 970-686-354-0.
- ↑ Cianuro de hidrógeno. Hoja de seguridad.
- ↑ Acetonitrilo. Fichas Internacionales de Seguridad Química.
- ↑ Propionitrilo. Fichas Internacionales de Seguridad Química.
- ↑ Butironitrilo. Fichas Internacionales de Seguridad Química.
- ↑ Pentanenitrile. Chemical Book (en inglés)
- ↑ Hexanonitrilo. MSDS (en inglés).
- ↑ Heptanenitrile. (en inglés).
- ↑ Octanenitrile. Safety Data Sheet (en inglés).
- ↑ nonanenitrile. Safety Data Sheet (en inglés).
- ↑ Decanenitrile. Safety Data Sheet (en inglés).
- ↑ Yúfera, Eduardo Primo (1996). «Nitrilos. Nitrilos y ácidos carboxílicos insaturados.». Química orgánica básica y aplicada: de la molécula a la industria, Volumen 1. Reverté. ISBN 84-291-7953-4.
Categorías:- Nitrilos
- Grupos funcionales
Wikimedia foundation. 2010.