- Hibridación (química)
-
En química, se habla de hibridación cuando en un átomo se mezclan varios orbitales atómicos para formar nuevos orbitales híbridos. Los orbitales híbridos explican la forma en que se disponen los electrones en la formación de los enlaces, dentro de la teoría del enlace de valencia, y justifican la geometría las moléculas.
Contenido
Orbitales
Los electrones de un átomo tienen la tendencia de ubicarse en orbitales específicos alrededor del núcleo, lo cual se enuncia en la ecuación de Schrödinger. Los detalles sobre número y orientación de electrones en cada orbital depende de las propiedades energéticas descritas por los números cuánticos. El primer orbital, el más cercano al núcleo es el llamado 1s y solo puede ser ocupado por dos electrones. Un átomo con un solo electrón (hidrógeno) y uno con dos electrones (helio) ubican su(s) electrón(es) en este orbital.
Un átomo con 3 (litio) y cuatro (berilio) electrones tendrá que ubicar el tercer y cuarto electrón en el siguiente orbital, llamado 2s, el cual también solo acepta dos electrones.
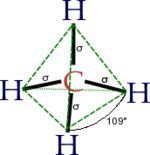
Hibridación sp³
El átomo de carbono tiene seis electrones: dos se ubican en el orbital 1s (1s²), dos en el 2s (2s²) y los restantes dos en el orbital 2p (2p²). Debido a su orientación en el plano tridimensional el orbital 2p tiene capacidad para ubicar 6 electrones: 2 en el eje de las x, dos en el eje de las y y dos electrones en el eje de las z. Los dos últimos electrones del carbono se ubicarían uno en el 2px, el otro en el 2py y el orbital 2pz permanece vacío (2px¹ 2py¹). El esquema de lo anterior es (cada flecha un electrón):

Para satisfacer su estado energético inestable, un átomo de valencia como el del carbono, con orbitales parcialmente llenos (2px y 2py necesitarían tener dos electrones) tiende a formar enlaces con otros átomos que tengan electrones disponibles. Para ello, no basta simplemente colocar un electrón en cada orbital necesitado. En la naturaleza, éste tipo de átomos redistribuyen sus electrones formando orbitales híbridos. En el caso del carbono, uno de los electrones del orbital 2s es extraido y se ubica en el orbital 2pz. Así, los cuatro últimos orbitales tienen un electrón cada uno:

El estímulo para excitar al electrón del 2s al 2pz es aportado por el primer electrón en formar enlace con un átomo con este tipo de valencia. Por ejemplo, el hidrógeno en el caso del metano. Esto a su vez incrementa la necesidad de llenado de los restantes orbitales. Estos nuevos orbitales híbridos dejan de ser llamados 2s y 2p y son ahora llamados sp3 (un poco de ambos orbitales):

De los cuatro orbitales así formados, uno (25%) es proveniente del orbital s (el 2s) del carbono y tres (75%) provenientes de los orbitales p (2p). Sin embargo todos se sobreponen al aportar la hibridación producto del enlace. Tridimensionalmente, la distancia entre un hidrógeno y el otro en el metano son equivalentes e iguales a un ángulo de 109°.
Hibridación sp²
Se define como la combinacion de un orbital S y 2 P, para formar 3 orbitales híbridos, que se disponen en un plano formando ángulos de 120º.
Los átomos que forman hibridaciones sp2 pueden formar compuestos con enlaces dobles. Forman un ángulo de 120º y su molécula es de forma plana. A los enlaces simples se les conoce como enlaces sigma (σ) y los enlaces dobles están compuestos por un enlace sigma y un enlace pi (π). Las reglas de ubicación de los electrones en estos casos, como el alqueno etileno obligan a una hibridación distinta llamada sp2, en la cual un electrón del orbital 2s se mezcla sólo con dos de los orbitales 2p: surge a partir o al unirse el orbital s con dos orbitales p; por consiguiente, se producen tres nuevos orbitales sp2, cada orbital nuevo produce enlaces covalentes

Tridimensionalmente, la distancia entre un hidrógeno y otro en algún carbono del etileno son equivalentes e iguales a un ángulo de 120°.
Hibridación sp
Se define como la combinacion de un orbital S y un P, para formar 2 orbitales híbridos, con orientacion lineal. Este es el tipo de enlace híbrido, con un ángulo de 180º y que se encuentra existente en compuestos con triples enlaces como los alquinos (por ejemplo el acetileno):

se caracteriza por la presencia de 2 orbitales pi(π).Forma y ángulos
Las formas de las moléculas enlazadas por hibridaciones de sus orbitales es forzada por los ángulos entre sus átomos:
- Sin hibridación: forma lineal
- Hibridación sp: forma lineal con ángulos de 180°
- Hibridación sp²: forma trigonal plana con ángulos de 120°. Por ejemplo BCl3.
- Hibridación sp³: forma tetraédrica con ángulos de 109.5°. Por ejemplo CCl4.
- Hibridación sp³d: forma trigonal bipiramidal con ángulos de 90° y 120°. Por ejemplo PCl5.
- Hibridación sp³d²: forma octaédrica con ángulos de 90°. Por ejemplo SF6.
Véase también
- Valencia atómica
- Orbital molecular
- Hibridación del carbono
Enlaces externos
- Ver representación de estas figuras.
Wikimedia foundation. 2010.