- Destilación
-
Destilación
La destilación es la operación de separar, mediante vaporización y recondensación, los diferentes componentes líquidos o licuados de una mezcla, aprovechando los diferentes puntos de ebullición (temperaturas de ebullición) de cada una de las sustancias a separar.
La destilación se da en forma natural debajo del punto de ebullición (100 ºC en el caso del agua), luego se condensa formando nubes y finalmente llueve.
Contenido
Destilación simple
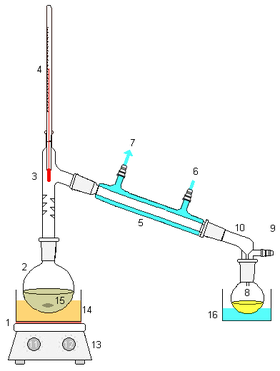
El aparato utilizado para la destilación en el laboratorio es el alambique. Consta de un recipiente donde se almacena la mezcla a la que se le aplica calor, un condensador donde se enfrían los vapores generados, llevándolos de nuevo al estado líquido y un recipiente donde se almacena el líquido concentrado.
En la industria química se utiliza la destilación para la separación de mezclas simples o complejas. Una forma de clasificar la destilación puede ser la de que sea discontinua o continua.
En el esquema ubicado a la derecha puede observarse un aparato de destilación simple básico:
- Mechero, proporciona calor a la mezcla a destilar.
- Retorta o matraz de fondo redondo, que deberá contener pequeños trozos de material poroso (cerámica, o material similar) para evitar sobresaltos repentinos por sobrecalentamientos.
- Cabeza de destilación: No es necesario si la retorta tiene una tubuladura lateral.
- Termómetro: El bulbo del termómetro siempre se ubica a la misma altura que la salida a la entrada del refrigerador. Para saber si la temperatura es la real, el bulbo deberá tener al menos una gota de líquido. Puede ser necesario un tapón de goma para sostener al termómetro y evitar que se escapen los gases (muy importante cuando se trabaja con líquidos inflamables).
- Tubo refrigerante.
- Entrada de agua: El líquido siempre debe entrar por la parte inferior, para que el tubo permanezca lleno con agua.
- Salida de agua: Casi siempre puede conectarse la salida de uno a la entrada de otro, porque no se calienta mucho el líquido.
- Se recoge en un balón, vaso de precipitados, u otro recipiente.
- Fuente de vacío: No es necesario para una destilación a presión atmosférica.
- Adaptador de vacío: No es necesario para una destilación a presión atmosférica.
Destilación fraccionada
La destilación fraccionada es una variante de la destilación simple que se emplea principalmente cuando es necesario separar líquidos con punto de ebullición cercanos.
La principal diferencia que tiene con la destilación simple es el uso de una columna de fraccionamiento. Ésta permite un mayor contacto entre los vapores que ascienden con el líquido condensado que desciende, por la utilización de diferentes "platos". Esto facilita el intercambio de calor entre los vapores (que ceden) y los líquidos (que reciben). Ese intercambio produce un intercambio de masa, donde los líquidos con menor punto de ebullición se convierten en vapor, y los vapores con mayor punto de ebullición pasan al estado líquido.
Destilación al vacío
La destilación a vacío es la operación complementaria de destilación del crudo procesado en la unidad de destilación atmosférica, que no se vaporiza y sale por la parte inferior de la columna de destilación atmosférica. El vaporizado de todo el crudo a la presión atmosférica necesitaría elevar la temperatura por encima del umbral de descomposición química y eso, en esta fase del refino de petróleo, es indeseable.
El residuo atmosférico o crudo reducido procedente del fondo de la columna de destilación atmosférica, se bombea a la unidad de destilación a vacío, se calienta generalmente en un horno a una temperatura inferior a los 400 ºC, similar a la temperatura que se alcanza en la fase de destilación atmosférica, y se introduce en la columna de destilación. Esta columna trabaja a vacío, con una presión absoluta de unos 20 mm de Hg, por lo que se vuelve a producir una vaporización de productos por efecto de la disminución de la presión, pudiendo extraerle más productos ligeros sin descomponer su estructura molecular.
En la unidad de vacío se obtienen solo tres tipos de productos:
- Gas Oil Ligero de vacío (GOL).
- Gas Oil Pesado de vacío (GOP).
- Residuo de vacío.
Los dos primeros, GOL y GOP, se utilizan como alimentación a la unidad de craqueo catalítico después de desulfurarse en una unidad de hidrodesulfuración (HDS).
El producto del fondo, residuo de vacío, se utiliza principalmente para alimentar a unidades de craqueo térmico, donde se vuelven a producir más productos ligeros y el fondo se dedica a producir fuel oil, o para alimentar a la unidad de producción de coque. Dependiendo de la naturaleza del crudo el residuo de vacío puede ser materia prima para producir asfaltos.
Destilación azeotrópica
En química, la destilación azeotrópica es una de las técnicas usadas para romper un azeótropo en la destilación. Una de las destilaciones más comunes con un azeótropo es la de la mezcla etanol-agua. Usando técnicas normales de destilación, el etanol solo puede ser purificado a aproximadamente el 95%.
Una vez se encuentra en una concentración de 95/5% etanol/agua, los coeficientes de actividad del agua y del etanol son iguales, entonces la concentración del vapor de la mezcla también es de 95/5% etanol-agua, por lo tanto destilaciones posteriores son inefectivas. Algunos usos requieren concentraciones de alcohol mayores, por ejemplo cuando se usa como aditivo para la gasolina. Por lo tanto el azeótropo 95/5% debe romperse para lograr una mayor concentración.
En uno de los métodos se adiciona un material agente de separación. Por ejemplo, la adición de benceno a la mezcla cambia la interacción molecular y elimina el azeótropo. La desventaja, es la necesidad de otra separación para retirar el benceno. Otro método, la variación de presión en la destilación, se basa en el hecho de que un azeótropo depende de la presión y también que no es un rango de concentraciones que no pueden ser destiladas, sino el punto en el que los coeficientes de actividad se cruzan. Si el azeótropo se salta, la destilación puede continuar.
Para saltar el azeótropo, el azeótropo puede ser movido cambiando la presión. Comúnmente, la presión se fija de forma tal que el azeótropo quede cerca del 100% de concentración, para el caso del etanol, éste se puede ubicar en el 97%. El etanol puede destilarse entonces hasta el 97%. Actualmente se destila a un poco menos del 95,5%. El alcohol al 95,5% se envía a una columna de destilación que está a una presión diferente, se mueve el azeótropo a una concentración menor, tal vez al 93%. Ya que la mezcla está por encima de la concentración azeotrópica actual, la destilación no se “pegará” en este punto y el etanol podrá ser destilado a cualquier concentración necesaria.
Para lograr la concentración requerida para el etanol como aditivo para la gasolina se usan comúnmente tamices moleculares en la concentración azeotrópica. El etanol se destila hasta el 95%, luego se hace pasar por un tamiz molecular que absorba el agua de la mezcla, ya se tiene entonces etanol por encima del 95% de concentración, que permite destilaciones posteriores. Luego el tamiz se calienta para eliminar el agua y puede ser reutilizado.
Destilación por arrastre de vapor
En la destilación por arrastre de vapor de agua se lleva a cabo la vaporización selectiva del componente volátil de una mezcla formada por éste y otros "no volátiles". Lo anterior se logra por medio de la inyección de vapor de agua directamente en el interior de la mezcla, denominándose este "vapor de arrastre", pero en realidad su función no es la de "arrastrar" el componente volátil, sino condensarse en el matraz formando otra fase inmisible que cederá su calor latente a la mezcla a destilar para lograr su evaporación. En este caso se tendrán la presencia de dos fases insolubles a lo largo de la destilación (orgánica y acuosa), por lo tanto, cada líquido se comportará como si el otro no estuviera presente. Es decir, cada uno de ellos ejercerá su propia presión de vapor y corresponderá a la de un líquido puro a una temperatura de referencia
La condición más importante para que este tipo de destilación pueda ser aplicado es que tanto el componente volátil como la impureza sean insolubles en agua ya que el producto destilado (volátil) formará dos capas al condensarse, lo cual permitirá la separación del producto y del agua fácilmente. Como se mencionó anteriormente, la presión total del sistema será la suma de las presiones de vapor de los componentes de la mezcla orgánica y del agua, sin embargo, si la mezcla a destilar es un hidrocarburo con algún aceite, la presión de vapor del aceite al ser muy pequeña se considera despreciable para efecto de los cálculos: P = Pa° + Pb°
Donde: P = presión total del sistema Pa°= presión de vapor del agua Pb°= presión de vapor del hidrocarburo Por otra parte, el punto de ebullición de cualquier sistema se alcanza a la temperatura a la cual la presión total del sistema es igual a la presión del confinamiento. Y como los dos líquidos juntos alcanzan una presión dada, más rápidamente que cualquiera de ellos solos, la mezcla hervirá a una temperatura más baja que cualquiera de los componentes puros. En la destilación por arrastre es posible utilizar gas inerte para el arrastre. Sin embargo, el empleo de vapores o gases diferentes al agua implica problemas adicionales en la condensación y recuperación del destilado o gas. El comportamiento que tendrá la temperatura a lo largo de la destilación será constante, ya que no existen cambios en la presión de vapor o en la composición de los vapores de la mezcla, es decir que el punto de ebullición permanecerá constante mientras ambos líquidos esten presentes en la fase líquida. En el momento que uno de los líquidos se elimine por la propia ebullición de la mezcla, la temperatura ascenderá bruscamente. Si en mezcla binaria designamos por na y nb a las fracciones molares de los dos líquidos en la fase vapor, tendremos: Pa° = na P Pb° = nbP dividiendo: Pa° = na P = na Pb° nb P nb na y nb son el numero de moles de A y B en cualquier volúmen dado de vapor, por lo tanto: Pa° = na Pb° nb y como la relación de las presiones de vapor a una "T" dada es constante, la relación na/nb, debe ser constante también. Es decir, la composición del vapor es siempre constante en tanto que ambos líquidos estén presentes. Además como: na = wa/Ma y nb= wb/Mb donde: wa y wb son los pesos en un volúmen dado y Ma, Mb son los pesos moleculares de A y B respectivamente. La ecuación se transforma en: Pa° = na = waMb Pb° nb wbMa O bien: wa = MaPa° wb MbPb° Esta última ecuación relaciona directamente los pesos moleculares de los dos componentes destilados, en una mezcla binaria de líquidos. Por lo tanto, la destilación por arrastre con vapor de agua, en sistemas de líquidos inmisibles en ésta se llega a utilizar para determinar los pesos moleculares aproximados de los productos o sustancias relacionadas. Es necesario establecer que existe una gran diferencia entre una destilación por arrastre y una simple, ya que en la primera no se presenta un equilibrio de fases líquido-vapor entre los dos componentes a destilar como se da en la destilación simple, por lo tanto no es posible realizar diagramas de equilibrio ya que en el vapor nunca estará presente el componente "no volátil" mientras este destilando el volátil. Además de que en la destilación por arrastre de vapor el destilado obtenido será puro en relación al componente no volátil (aunque requiera de un decantación para ser separado del agua), algo que no sucede en la destilación simple donde el destilado sigue presentando ambos componentes aunque más enriquecido en alguno de ellos. Además si este tipo de mezclas con aceites de alto peso molecular fueran destiladas sin la adición del vapor se requeriría de gran cantidad de energía para calentarla y emplearía mayor tiempo, pudiéndose descomponer si se trata de un aceite esencial.
Destilación mejorada
Cuando existen dos o más compuestos en una mezcla que tienen puntos de ebullición relativamente cercanos, es decir, volatilidad relativa menor a 1 y que forma una mezcla no ideal es necesario considerar otras alternativas mas economicas a la destilación convencional, como son:
- Destilación extractiva
- Destilación reactiva
Estas técnicas no son ventajosas en todos los casos y las reglas de análisis y diseño pueden no ser generalizadas para todos los sistemas, por lo que cada mezcla debe ser analizada cuidadosamente para encontrar las mejores condiciones de operación.
Véase también
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Destilación.
Wikimedia Commons alberga contenido multimedia sobre Destilación.- Al-Ambik.es: Funcionamiento de un alambique e información acerca de la destilación
Categorías: Operaciones de separación | Procesos de separación | Ingeniería del petróleo | Destilación
Wikimedia foundation. 2010.