- Punto triple
-
Punto triple
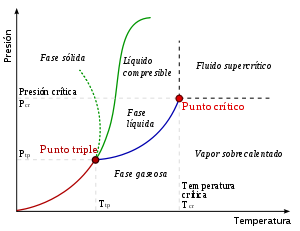 Un típico diagrama de fase. La línea verde marca el punto de congelación, la azul, el punto de ebullición y la roja el punto de sublimación. Se muestra como estos varían con la presión. El punto de unión entre las líneas verde, azul y roja es el punto triple. La línea con puntos muestra el comportamiento anómalo del agua.
Un típico diagrama de fase. La línea verde marca el punto de congelación, la azul, el punto de ebullición y la roja el punto de sublimación. Se muestra como estos varían con la presión. El punto de unión entre las líneas verde, azul y roja es el punto triple. La línea con puntos muestra el comportamiento anómalo del agua.
El punto triple es aquel en el cual coexisten en equilibrio el estado sólido, el estado líquido y el estado gaseoso de una sustancia. Se define con una temperatura y una presión de vapor.
El punto triple del agua, por ejemplo, está a 273,16 K (0,01°C) y a una presión de 611,73 Pa ITS90. Esta temperatura, debido a que es un valor constante, sirve para calibrar las escalas Kelvin y Celsius de los termómetros de mayor precisión.
Punto triple del agua
La única combinación de presión y temperatura a la que el agua, hielo y vapor de agua pueden coexistir en un equilibrio estable se produce exactamente a una temperatura de 273.1598 K (0.0098 ° C) y a una presión parcial de vapor de agua de 611,73 pascales (6,1173 milibares, 0,0060373057 atm). En ese momento, es posible cambiar el estado de toda la sustancia a hielo, agua o vapor arbitrariamente haciendo pequeños cambios en la presión y la temperatura. Se debe tener en cuenta que incluso si la presión total de un sistema está muy por encima de 611,73 pascales (es decir, un sistema con una presión atmosférica normal), si la presión parcial del vapor de agua es 611,73 pascales, entonces el sistema puede encontrarse aún en el punto triple del agua . Estrictamente hablando, las superficies que separan las distintas fases también debe ser perfectamente planas, para evitar los efectos de las tensiones de superficie.
El agua tiene un inusual y complejo diagrama de fase (aunque esto no afecta a las consideraciones generales expuestas sobre el punto triple). A altas temperaturas, incrementando la presión, primero se obtiene agua líquida y, a continuación, agua sólida. Por encima de 109 Pa aproximadamente se obtiene una forma cristalina de hielo que es más denso que el agua líquida. A temperaturas más bajas en virtud de la compresión, el estado líquido deja de aparecer, y el agua pasa directamente de sólido a gas.
A presiones constantes por encima del punto triple, calentar hielo hace que se pase de sólido a líquido y de éste a gas, o vapor. A presiones por debajo del punto triple, como las encontradas en el espacio exterior, donde la presión es cercana a cero, el agua líquida no puede existir. En un proceso conocido como sublimación, el hielo salta la fase líquida y se convierte directamente en vapor cuando se calienta.
La presión del punto triple del agua fue utilizada durante la misión Mariner 9 a Marte como un punto de referencia para definir "el nivel del mar". Misiones más recientes hacen uso de altimetría láser y gravimetría en lugar de la presión atmosférica para medir la elevación en Marte.
Tabla de puntos triples
En esta tabla se incluyen los puntos triples de algunas sustancias comunes. Estos datos están basados en los proporcionados por la National Bureau of Standards (ahora NIST) de los EE.UU de América.[1]
Sustancia T (K) P (kPa) Acetileno 192,4 120 Amoníaco 195,40 6,076 Argón 83,81 68,9 Grafito 3900 10100 Dióxido de carbono 216,55 517 Monóxido de carbono 68,10 15,37 Deuterio 18,63 17,1 Etano 89,89 8 × 10−4 Etileno 104,0 0,12 Helio-4 2,19 5,1 Hidrógeno 13,84 7,04 Cloruro de hidrógeno 158,96 13,9 Mercurio 234,2 1,65 × 10−7 Metano 90,68 11,7 Neón 24,57 43,2 Óxido nítrico 109,50 21,92 Nitrógeno 63,18 12,6 Óxido nitroso 182,34 87,85 Oxígeno 54,36 0,152 Paladio 1825 3,5 × 10−3 Platino 2045 2,0 × 10−4 Dióxido de azufre 197,69 1,67 Titanio 1941 5,3 × 10−3 Hexafluoruro de uranio 337,17 151,7 Agua 273,16 0,61 Xenón 161,3 81,5 Zinc 692,65 0,065 Referencias
- ↑ Yunus A. Cengel, Robert H. Turner. Fundamentals of thermal-fluid sciences. McGraw-Hill, 2004, p. 78. ISBN 0-07-297675-6
Categoría: Termodinámica
Wikimedia foundation. 2010.
