- Solvatación
-
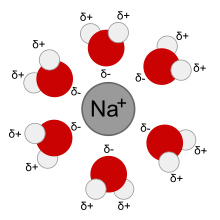
La solvatación es el proceso de asociación de moléculas de un disolvente con moléculas o iones de un soluto. Al disolverse los iones en un solvente, se dispersan y son rodeados por moléculas de solvente. A mayor tamaño del ion, más moléculas de solvente son capaces de rodearlo, y más solvatado se encuentra el ion.
Contenido
Diferencia entre solvatación, disolución y solubilidad
Por definición de la IUPAC,[1] la solvatación es una interacción de un soluto con un solvente que conduce a la estabilización de las especies del soluto en la solución. También se puede referir a estado solvatado, donde un ion en una solución está complexado por moléculas del solvente. El concepto de interacción de solvatación también puede ser aplicado a un material insoluble, por ejemplo, la solvatación de los grupos funcionales en la superficie de una resina de intercambio iónico.
El fenómeno de solvatación debería ser separado conceptualmente del soluto y de la propiedad de solubilidad. La disolución es un proceso cinético, y se cuantifica por su velocidad. La solubilidad cuantifica el estado de equilibrio dinámico alcanzado cuando la velocidad de disolución iguala a la velocidad de precipitación.
Si se consideran las unidades puede hacerse una distinción más clara. La complexación puede ser descrita por el número de coordinación, y la constante de estabilidad del complejo. La unidad típica para la velocidad de disolución es mol/s. La unidad para la solubilidad puede ser mol/kg.
Solventes e interacciones intermoleculares
Los solventes polares son aquellos con una estructura molecular que contiene dipolos. Tales compuestos suelen tener una alta constante dieléctrica. Las moléculas polares de estos solventes pueden solvatar iones porque pueden orientar la porción parcialmente cargada de la molécula hacia el ion en respuesta a la atracción electrostática. Esto estabiliza el sistema. El agua es el solvente polar más común y mejor estudiado, pero existen otros, como el acetonitrilo, dimetil sulfóxido, metanol, carbonato de propileno, amoníaco, etanol y acetona. Estos solventes pueden ser usados para disolver compuestos inorgánicos como las sales.
La solvatación involucra a diferentes tipos de interacciones moleculares: puente de hidrógeno, ion-dipolo, atracción dipolo-dipolo o fuerzas de London. Los tres primeros pueden estar presentes sólo en solventes polares. Las interacciones ion-ion sólo pueden suceder en solventes iónicos (por ejemplo, en fase fundida). Los procesos de solvatación sólo estarán termodinámicamente favorecidos si la energía libre de Gibbs de formación de la solución es menor que la suma de la energía libre de Gibbs de formación del solvente y el soluto por separado.
La conductividad de una solución depende de la solvatación de sus iones.
Aspectos termodinámicos
Para que suceda la solvatación, se necesita la liberación de los iones individuales de la red cristalina en la que están presentes. Es necesario romper las atracciones que los iones tienen entre sí, atracción representada por la energía libre de la red del soluto en su estado de agregación natural. La energía para esto se obtiene de la energía liberada cuando los iones de la red del soluto se asocian con las moléculas del solvente. La energía liberada en esta forma se conoce como energía libre de solvatación.
El cambio de entalpía de solución es la entalpía de formación de la solución menos la suma de las entalpías de formación de los sistemas separados, mientras que el cambio de entropía es la diferencia correspondiente en las entropías de formación. La mayoría de gases tiene una entalpía de solución negativa, lo que implica que son menos solubles a temperaturas más altas.
Aunque en un principio se creía que una mayor relación carga/tamaño del ion, o densidad de carga, implicaba una mayor solvatación, esto no resulta cierto para iones como hierro(III) o los lantánidos y actínidos, que son hidrolizados rápidamente para formar óxidos insolubles.
La entalpía de solvatación puede explicar por qué la solvatación ocurre con algunas redes iónicas, mientras con otras no. Un valor negativo de cambio de entalpía de solución corresponde a un ion que se disolverá, mientras que un valor positivo significa que la solvatación no sucederá fácilmente. Una medida cuantitativa del poder de solvatación de los solventes es el número donor.
Véase también
- Complejo
- Solubilidad
- Disolución
- Solvente
Referencias
- ↑ IUPAC Compendium of Chemical Terminology, Electronic version, http://goldbook.iupac.org/S05747.html
Categoría:- Procesos químicos
Wikimedia foundation. 2010.