- 1,5-ciclooctadieno
-
1,5-ciclooctadieno
Nombre (IUPAC) sistemático n/d General Otros nombres COD Fórmula estructural C8H12 Fórmula molecular n/d Identificadores Número CAS 111-78-4 Propiedades físicas Estado de agregación líquido Apariencia claro incoloro Densidad 0,882 kg/m3; 882 g/cm3 Masa molar n/d Punto de fusión 203,5 K (-69,65 °C) Punto de ebullición 424 K (150,85 °C) Propiedades químicas Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl 1,5-ciclooctadieno es un compuesto orgánico con la fórmula química C8H12 y es uno de los isómeros posibles del ciclooctadieno, generalmente abreviado como COD o cod. Este dieno es un precursor para sintetizar otros compuestos orgánicos y sirve como ligando en la química organometálica.[1] [2]
Contenido
Síntesis
El 1,5-ciclooctadieno puede ser preparado por dimerización del butadieno en presencia de un catalizador de níquel, obteniéndose comon subproducto el vinilciclohexeno. Aproximadamente se produjeron 10.000 toneladas de este producto en el año 2005.[3]
Reacciones orgánicas
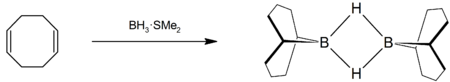
El COD reacciona con borano para dar 9-borabiciclo[3.3.1]nonano,[4] comúnmente conocido como 9-BBN, un reactivo de química orgánica utilizado en hidroboraciones:
El COD se añade a dicloruro de azufre SCl2 (o reactivos similares) para dar 2,6-dicloro-9-tiabiciclo[3.3.1]nonano:[5]
El dicloruro resultante se puede modificar posteriormente como derivado di-azida o di-ciano en una sustitución nucleófila con la ayuda de asistencia anquimérica.
Complejos metálicos
El 1,5-COD normalmente se une a metales de valencia baja a través de los dos grupos alqueno. El complejo de Ni(COD)2 es un precursor de varios complejos de níquel(0) y de Ni(II). Los complejos metálicos de COD son atractivos porque son lo suficientemente estables como para ser aislados, siendo a menudo más robustos que los complejos de etileno relacionados. La estabilidad de los complejos de COD es atribuible al efecto quelato. Los ligandos COD son fácilmente desplazados por otros ligandos, tales como las fosfinas.
El complejo Ni(COD)2 es preparado por reducción de acetilacetonato de níquel anhidro en presencia del ligando, utilizando trietilaluminio[6]
- 1/3 [Ni(C5H7O2)2]3 + 2 COD + 2 Al(C2H5)3 → Ni(COD)2 + 2 Al(C2H5)2(C5H7O2) + C2H4 + C2H6
El compuesto similar Pt(COD)2 se prepara por una vía más compleja con la participación de ciclooctatetraeno de dilitio:[7]
- Li2C8H8 + PtCl2(COD) + 3 C7H10 → [Pt(C7H10)3] + 2 LiCl + C8H8 + C8H12
- Pt(C7H10)3 + 2 COD → Pt(COD)2 + 3 C7H10
Se han elaborado muchos trabajos sobre los complejos de COD, gran parte de los cuales han aparecido en la revista Inorganic Syntheses. El complejo de platino se ha utilizado en muchas síntesis:
- Pt(COD)2 + 3 C2H4 → Pt(C2H4)3 + 2 COD
Los complejos de COD son útiles como materiales de partida, un ejemplo notable es la reacción:
- Ni(cod)2 + 4 CO(g)
 Ni(CO)4 + 2 COD
Ni(CO)4 + 2 COD
El producto Ni(CO)4 es altamente tóxico, por lo que es ventajoso producirlo en el recipiente de reacción en lugar de ser dispensados directamente. Otros complejos de COD con metales de bajo estado de oxidación son Mo(COD)(CO)4, [RuCl2(COD)]n, y Fe(COD)(CO)3. El COD es de especial importancia en la química de coordinación del rodio(I) y del iridio(I), siendo ejemplos el catalizador de Crabtree y el dímero cloruro de ciclooctadienorodio. Se conocen complejos planos cuadrados del tipo [M(COD)2]+ (donde M = Rh, Ir).
(E,E)-COD
El isómero trans-trans del 1,5-ciclooctadieno, de elevada tensión estructural, es un compuesto conocido. (E,E)-COD fue sintetizado por primera vez por George M. Whitesides y Arthur C. Cope en 1969 por fotoisomerización del compuesto cis.[8] Otra síntesis (reacción de doble eliminación de un anillo ciclooctano) fue realizada por Rolf Huisgen en 1987.[9] La conformación molecular de (E,E)-COD está retorcida en lugar de tener la estructura tipo silla. El compuesto ha sido investigado como un mediador en química click.[10]
Referencias
- ↑ Buehler, C; Pearson, D.Survey of Organic Syntheses. Wiley-Intersciene, New York. 1970.
- ↑ Shriver, D; Atkins, P.Inorganic Chemistry. W. H. Freeman and Co., New York. 1999.
- ↑ Thomas Schiffer, Georg Oenbrink “Cyclododecatriene, Cyclooctadiene, and 4-Vinylcyclohexene” in Ullmann’s Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim.
- ↑ John A. Soderquist and Alvin Negron (1998). "9-Borabicyclo[3.3.1]nonane Dimer". Org. Synth.; Coll. Vol. 9: 95.
- ↑ Roger Bishop. "9-Thiabicyclo[3.3.1]nonane-2,6-dione". Org. Synth.; Coll. Vol. 9: 692. Díaz, David Díaz (2006). «2,6-Dichloro-9-thiabicyclo[3.3.1]nonane: Multigram Display of Azide and Cyanide Components on a Versatile Scaffold». Molecules 11: pp. 212–218. doi:. http://www.mdpi.org/molecules/papers/11040212.pdf.
- ↑ Schunn, R; Ittel, S. (1990). «Bis(1,5-Cyclooctadiene) Nickel(0)». Inorg. Synth. 28: pp. 94. doi:.
- ↑ Crascall, L; Spencer, J. (1990). «Olefin Complexes of Platinum». Inorg. Synth. 28: pp. 126. doi:.
- ↑ Irradiation of cis,cis-1,5-cyclooctadiene in the presence of copper(I) chloride George M. Whitesides, Gerald L. Goe, Arthur C. Cope J. Am. Chem. Soc., 1969, 91 (10), pp 2608–2616 doi 10.1021/ja01038a036
- ↑ Preparation and conformation of (E,E)-1,5-cyclooctadiene Dieter Boeckh, Rolf Huisgen, Heinrich Noeth J. Am. Chem. Soc., 1987, 109 (4), pp 1248–1249 doi 10.1021/ja00238a046
- ↑ (E,E)-1,5-Cyclooctadiene: a small and fast click-chemistry multitalent Henning Stöckmann, André A. Neves, Henry A. Day, Shaun Stairs, Kevin M. Brindle and Finian J. Leeper Chem. Commun., 2011 doi 10.1039/C1CC12161H
Categorías:- Cicloalquenos
- Dienos
Wikimedia foundation. 2010.

![Síntesis y reacciones de 2,6-Dicloro-9-tiabiciclo[3.3.1]nonano](/pictures/eswiki/52/450px-CODSCl2.png)
