- Fosfina
-
Fosfina

Nombre (IUPAC) sistemático Fosfano
Hidruro fosforoso
Trihidruro de fósforoGeneral Otros nombres Fosfamina
Hidrógeno fosforadoFórmula semidesarrollada PH3 Fórmula molecular n/d Identificadores Número CAS 7803-51-2 Propiedades físicas Estado de agregación Gas Apariencia Gas incoloro Densidad 1.379 kg/m3; 0.001 g/cm3 Masa molar 34 g/mol Punto de fusión 139 K (-134,15 °C) Punto de ebullición 185 K (-88,15 °C) Propiedades químicas Solubilidad en agua 31.2 mg/100 ml Momento dipolar 0.58 D Compuestos relacionados Otros hidruros Amoníaco
Arsina
Estibina
BismutinaCompuestos orgánicos Trimetilfosfina
TrifenilfosfinaPeligrosidad NFPA 704 Temperatura de autoignición 311 K (38 °C) Frases R R12, R17, R26, R34, R50 Frases S (S1/2), S28, S36/37, S45, S61, S63 Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasLa fosfamina o fosfina (PH3) es un gas incoloro, inflamable, que explota a temperatura ambiente y que huele a ajo o a pescado podrido. Pequeñas cantidades ocurren naturalmente provenientes de la degradación de materia orgánica. Es levemente soluble en agua.
La fosfamina es usada en las industrias de semiconductores y de plásticos, en la producción de un retardador de llamas y como insecticida en granos almacenados.
Contenido
Propiedades físicas y químicas
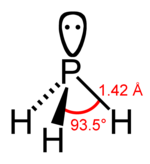
La fosfamina se llama también fosfuro de hidrógeno o hidrógeno fosforado. Es una molécula polar. Es un gas incoloro, poco soluble en el agua, que se reconoce por su olor aliáceo y su gran combustibilidad. Al aire arde con llama de color blanco y muy brillante, desprendiendo vapores de ácido fosfórico, según la reacción: PH3 + 2O2 --> H3PO4 Es un poderoso reductor que se apropia del Oxígeno de muchos cuerpos para transformarse en ácido fosfórico. Por esta propiedad es extremadamente venenoso, pues deja al cuerpo humano sin oxígeno necesario. Se une con los hidrácidos para formar compuestos que son isomorfos con las sales amónicas, por ejemplo: PH3 + HCl --> PH4Cl. El radical PH4+ monovalente se llama fosfonio y es parecido al amonio (NH4+).
Características
- Fórmula: PH3
- Masa molecular: 34 u;
- Solubilidad a 15 °C: 112 cm³;
- Valencia del Fósforo: -3;
- Estado físico (a 20 °C): gas incoloro;
- Densidad: 1.18
Toxicidad
La ruta más probable de exposición a la fosfamina es la inhalación. Los primeros síntomas de exposición aguda a la fosfina incluyen dolor del diafragma, náusea, vómitos, excitación y un olor a fósforo en el aliento. La exposición a niveles más altos puede producir debilidad, bronquitis, edema pulmonar, falta de aliento, convulsiones y la muerte. Algunos efectos, como por ejemplo edema pulmonar, convulsiones y daño del hígado pueden manifestarse o aun estar presentes días después de la exposición.
La exposición prolongada a bajos niveles de fosfamina puede producir anemia, bronquitis, efectos gastrointestinales, y problemas motores, de la vista y del habla.
El contacto de la fosfamina líquida con la piel puede producir congelación. La ingestión de fosfuro metálico puede producir la liberación de fosfina en el estómago lo que puede causar náusea, vómitos, dolor abdominal y diarrea.
No hay ninguna información disponible acerca de los posibles efectos de la fosfamina sobre la reproducción en seres humanos. No se ha demostrado que la fosfina afecta la reproducción en animales de laboratorio.
Fosfinas orgánicas
Relacionadas al PH3 es la clase de los compuestos de organofósforo comúnmente denominados "fosfinas". Estos derivados de alquilo y arilo de la fosfina son análogos a las aminas orgánicas. Algunos ejemplos comunes incluyen a la trifenilfosfina ((C6H5)3P) y BINAP, ambos usados como ligandos en catálisis homogénea, o la triisopropilfosfina. Las fosfinas son oxidadas fácilmente a óxidos de fosfina como está ejemplificado por la síntesis directa de una fosfa-corona, el análogo de fósforo de una aza corona[1] donde no es posible aislar la fosfina propiamente.[2]
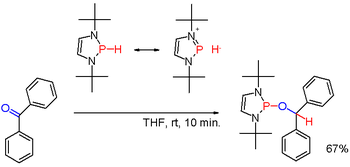
Cuando se modifica con sustituyentes adecuados como en ciertos (raros) diazafosfolenos, la polaridad del enlace P-H puede ser invertida (ver: umpolung) y el hidruro de fosfina resultante puede reducir un grupo carbonilo.[3]
Referencias
- ↑ Edwards, P. G.; Haigh, R.; Li, D.; Newman, P. D. "Template Synthesis of 1,4,7-Triphosphacyclononanes." J. Am. Chem. Soc. 2006, 128, 3818–3830. doi 10.1021/ja0578956
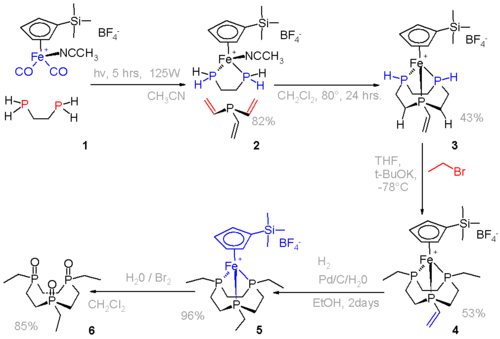
- ↑ En el paso 1, el difosfinoetano se coordina a un ferroceno que contiene ligandos adicionales de carbonilo y un ligando acetonitrilo. El siguiente paso es una hidrofosfinación con trivinilfosfina, seguida por la alquilación con bromuro de etilo y la hidrogenación con hidrógeno sobre paladio depositado en carbono. En el paso final, el sistema de hierro es eliminado por el bromo, pero la oxidación de los grupos fosfina es inevitable
- ↑ Burck, S.; Gudat, D.; Nieger, M.; Du Mont, W.-W. "P-Hydrogen-Substituted 1,3,2-Diazaphospholenes: Molecular Hydrides." J. Am. Chem. Soc. 2006, 128, 3946–3955. doi 10.1021/ja057827j
- ATSDR en Español - ToxFAQs™: fosfina
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química de la fosfina.
Categorías:- Hidruros
- Compuestos de fósforo
Wikimedia foundation. 2010.