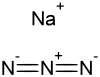- Azida
-
Azida
Azida es el anión con fórmula N3-. Es la base conjugada del ácido hidrazóico. La azida es también un grupo funcional en química orgánica, RN3.[1] N3- es un anión linear que tiene propiedades isoelectrónicas con CO2 y N2O. Debido a la teoría enlaces valencia la azida puede ser descrita con diferentes estructuras resonantes, una de las más importantes es N-=N+=N-.
Contenido
Azidas inorgánicas
Los Azidas pueden formar compuestos con enlaces covalentes e iónico con los metales. La azida sódica, NaN3, es una sal que generalmente se emplea como prolenate en la fabricación de airbags. N3-. Las azidas de origen covalente son muy numerosas,[2] un ejemplo es [Co(NH3)5N3]Cl2. Los compuestos organometálicos en los que se encuentra involucrado la azida es trimetilsilicioazida (Grupo [−Si(CH3)3]) el cual es a veces una fuente de anhidrosa de N3-.
Azidas en bioquímica
La forma aniónica de la azida es tóxica, tiene como función inhibir al citocromo c oxidasa haciendo un enlace irreversible con el cofactor hemo, en un proceso similar al realizado por el monóxido de carbono. Las sales de la azida son empleadas generalmente en bioquímica como elementos de mutagénesis.
Seguridad
- La azida sódica, NaN3 es tóxica (LD50 en dosis orales en ratas de 27 mg/kg) y puede ser absorbido a través de la piel.
- Los metales pesados con azidas, tales como la azida de plomo son muy explosivas cuando son calentadas o agitadas.
- La azida sódica se descompone explosivamente cuando se calienta por encima de los 275 °C.
- La azida sódica reacciona violentamente con CS2, bromo, ácido nítrico, dimetil sulfato, y una serie de metales pesados, incluyendo el cobre y el plomo.
- En reación con aguar o ácidos Brønsted son altamente tóxicos y explosivos liberando azida de hidrógeno.
- Se ha reportado que la azida sódica y los polímeros basados en reactivos azida con contenido de diclorometano y cloroformo forman di- y triazidometano respectivamente, ambos son inestables en altas concentraciones cuando se hallan presentes en disolución. Diversas explosiones devastadoras han sido divulgadas por la literatura especializada cuando se realizaban mezclas concentradas mediante un evaporador rotatori. Los peligros del diazidometano (y del triazidometano) han sido documentados por A. Hassner et al.[3]
- Las azidas de metales pesados son altamente explosivos bajo presiones repentinas, sobre todo cuando se emplea sodio y por esta razón deben tenerse precauciones cuando se almacenan, lo mismo ocurre con los vapores de HN3 cuando entran en contacto con metales pesados o sus sales. Las azidas de sales con metales pesados pueden acumularse bajo ciertas circunstancias, por ejemplo, tubos de metal o en secadores por liofilización, evitando de esta forma violentas explosiones. Algunos de los compuestos orgánicos basados en azidas se clasifican como altamente explosivos y tóxicos (las azidas inorgánicas se clasifican como neurotoxinas; los iones azida como inhibidores del citochromo c oxidasa (COX)).
- Los iodoazida en estado sólido son explosivos y no deberían prepararse en ausencia de un solvente.[4]
Véase también
- Grupo funcional
- Airbags (Uso de la azida sódica, NaN3)
Referencias
- ↑ Review: S. Bräse, C. Gil, K. Knepper, V. Zimmermann, Angew. Chem. 2005, 117, 5320-5374; Angew. Chem. Int. Ed. 2005, 44, 5188-5240.
- ↑ Tornieporth-Oetting, I. C.; Klapoetke, T. M. "Covalent Inorganic Azides" Angewandte Chemie, International Edition in English (1995), volume 34, pages 511-20. AN 1995:483017
- ↑ A. Hassner et al., Angew. Chem. Int. Ed. Engl., 25, 479 (1986), J. Org. Chem., 55, 2304 (1990).
- ↑ L. Marinescu, J. Thinggaard, I. B. Thomsen, M. Bols, J. Org. Chem. 2003, 68, 9453 – 9455.
Enlaces externos
Categorías: Grupos funcionales | Compuestos de nitrógeno
Wikimedia foundation. 2010.