- Genes homeóticos
-
Los genes homeóticos son genes que participan en el desarrollo de los organismos y que determinan la identidad de los segmentos o partes individuales del embrión en sus etapas iniciales. La función normal de los genes homeóticos consiste en conferir a la célula identidad espacial o posicional inequívoca en diferentes regiones a lo largo del eje anteroposterior del cuerpo. Estos genes indican a la célula si forma parte de la cabeza, del tórax o del abdomen del individuo.
Los genes homeóticos se activan posteriormente a la expresión de otros genes implicados en el desarrollo. En el caso de Drosophila melanogaster, en primer lugar se expresan los genes de polaridad del huevo, que determinan los ejes anteroposterior y dorsoventral del huevo; después lo hacen los genes de segmentación, que determinan el número y la organización de los segmentos del cuerpo. Los productos de estos genes activan a los genes homeóticos que determinan la identidad de cada segmento.
El término homeótico viene del griego homeo, que significa semejante. Los genes homeóticos reciben este nombre porque tras sufrir una mutación adquieren la capacidad de transformar un segmento de su cuerpo en una réplica de otro. Ejemplos típicos en Drosophila melanogaster son las mutaciones Antennapedia y Bithorax. La primera tiene como resultado la aparición de patas en lugar de las antenas; la segunda provoca la transformación de los halterios en un par de alas adicional.
Aunque inicialmente se descubrieron en Drosophila melanogaster, los genes homeóticos se han identificado en la mayoría de los seres vivos, incluidos los seres humanos. En éstos, al igual que en el resto de los organismos, la mutaciones que afectan a estos genes son responsables de la aparición de alteraciones en el desarrollo corporal.
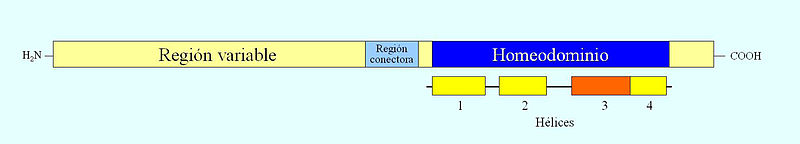
Los genes homeóticos codifican proteínas que se unen al ADN y cuya función es activar a otros genes. Todos contienen una secuencia muy conservada de 180 nucleótidos, llamada caja homeótica. Ésta se traduce en una región de 60 aminoácidos dentro de la proteína que codifican, el llamado homeodominio, que permite la unión de esta proteína reguladora a la doble hélice del ADN. Los genes homeóticos presentan ligamiento físico, es decir, aparecen organizados en complejos o clusters dentro del mismo cromosoma. Muestran colinealidad espacial, es decir, el orden que muestran en el cromosoma corresponde al orden de expresión en el eje anteroposterior de animal. Los genes del extremo 3’ se expresan en la parte anterior del animal, mientras que los situados en el extremo 5’ lo hacen en la parte más posterior del mismo. Existe además colinealidad temporal: los genes de un extremo del complejo se activan en primer lugar y la expresión de los genes se inicia progresivamente a lo largo del cluster hasta que lo hacen los del extremo opuesto.
Hasta el momento se han identificado distintos tipos de genes con caja homeótica: los genes Hox, los genes ParaHox y los genes NK. En vegetales se han localizado genes homeóticos como los genes con cajas MADS de Arabidopsis que controlan el desarrollo floral.
Aspectos históricos
Las mutaciones homeóticas se identificaron por primera vez en 1894 cuando William Bateson observó que en ocasiones las partes florales de las plantas aparecían en lugares equivocados. Encontró flores en las que los estambres crecían en el lugar donde solían hacerlo los pétalos.
En 1918 Harrison realizó transplantes de fragmentos de mesodermo de néurulas de anfibios. Si se transplantaba mesodermo de la región de los miembros anteriores, el receptor desarrollaba un miembro anterior supernumerario. Harrison observó que si bien el mesodermo tenía en esos embriones la apariencia de una capa uniforme, las células ya sabían de algún modo a qué parte del cuerpo pertenecían.
Tras Harrison numerosos investigadores establecieron con experimentos similares que el mesodermo constituye la capa celular crucial que especifica qué extremo del embrión es la cabeza y cuál es la cola. El mesodermo de la néurula de anfibios se cartografió o subdividió en campos morfogenéticos para varios órganos: branquias, balancines, miembros anteriores, miembros posteriores, cola, etc.
En 1923 Bridges y Morgan aislaron en Drosophila melanogaster un mutante con cuatro alas, llamado Bithorax, demostrando así que las transformaciones homeóticas tenían una base genética. En 1948 Edward B. Lewis descubrió que las transformaciones homeóticas podían deberse a mutaciones en genes individuales, aun cuando se hubieran necesitados cientos de genes activos para desarrollar las alas y las patas en su ubicación anormal. Por consiguiente, era razonable suponer que las mutaciones afectaban a genes rectores que dirigían la actividad de varios genes subordinados.
Lewis descubrió que el par extra de alas en los mutantes era debido a la duplicación de un segmento del cuerpo, el segundo segmento torácico. La inactividad del primer gen del complejo Bithorax en el segmento apropiado larvario hacía que otros genes homeóticos formaran alas en lugar de halterios.
A finales de la década de 1970 Nüsslein-Volhard y Wieschaus secuenciaron los genes homeóticos que controlan el desarrollo del cuerpo de la mosca de la fruta. Observaron que en cada uno de estos genes había una segmento de 180 pares de bases virtualmente idéntico. Esta secuencia proteica se une al ADN y activa el proceso de la transcripción. Mediante el control de la transcripción los genes homeóticos activan del crecimiento y desarrollo de las células.
En 1983 Gehring y William J. McGinnis descubrieron que el gen Antennapedia contenía una secuencia de ADN que se encontraba también en otro gen rector del desarrollo. Esta secuencia se utilizó como sonda para localizar otros genes que contuvieran la misma región aislando, de este modo, otros genes homeóticos. McGinnis descubrió que esta región conservada de ADN también se encuentra en otros invertebrados a la que se denominó homeobox o caja homeótica.
Lewis había observado en Drosophila que los genes homeóticos se encuentran ordenados en los cromosomas agrupados en complejos. Robb Krumlauf y Denis Duboule demostraron que estos genes están dispuestos en un orden preciso en el cromosoma y que este orden se corresponde con el lugar de expresión de los genes en el embrión. Los genes situados en un extremo se expresaban en las regiones anteriores del cuerpo mientras que los situados en el extremo opuesto lo hacían en la región posterior.
En 1995 Lewis, Nüsslein-Volhard y Wieschaus recibieron el premio Nobel por sus trabajos sobre los genes homeóticos.
Estructura y función de los genes homeóticos
Los genes homeóticos aparecen agrupados en complejos (clusters) y codifican proteínas reguladores que se unen al ADN. Todos ellos tienen una secuencia constante de 180 nucleótidos que en su conjunto se denomina caja homeótica (homeobox). Estas secuencias también se han encontrado en genes de segmentación y en otros que regulan el desarrollo espacial.
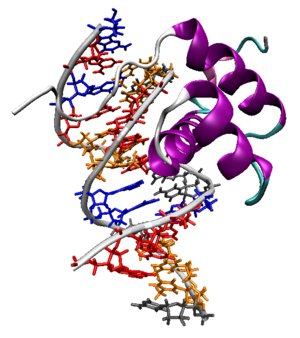
Las proteínas que codifican estos genes tienen una región variable cuya secuencia de aminoácidos varía mucho de una especie a otra y una región altamente conservada a lo largo de la evolución en los organismos pluricelulares constituida por 60 aminoácidos y denominada homeodominio. Éste está codificado por la caja homeótica. Estas proteínas actúan como factores de transcripción y tienen la capacidad de unirse a secuencias reguladoras de otros genes como son los intensificadores o enhancers. Los homeodominios se estructuran en varios segmentos helicoidales, de los cuales uno de ellos, la hélice 3, se une al surco mayor del ADN.
Una característica importante de los genes homeóticos es su ligamiento físico. Suelen estar agrupados en el mismo cromosoma formando complejos. A lo largo de la evolución, estos genes han permanecido generalmente agrupados, ya que esta agrupación es esencial para el desarrollo. Estos genes muestran el fenómeno de la colinealidad espacial, es decir, que además de estar en el mismo cromosoma, su orden en el mismo corresponde al orden de expresión en el eje anteroposterior de animal. Los genes del extremo 5’ se expresan en la parte más posterior del animal, mientras que los del extremo 3’ lo hacen en la parte más anterior del animal. También existe una colinealidad temporal. En la mayoría de los animales, los genes de un extremo del complejo se activan en primer lugar y la expresión de los genes se inicia progresivamente a lo largo del complejo hasta que lo hacen los del extremo opuesto.
Los genes homeóticos se encuentran en todas las células del organismo pero sólo se manifiestan en determinadas regiones del embrión. Cuando en una determinada zona no se expresa un gen, las células embrionarias experimentan una transformación homeótica, debida a que lo hace otro gen homeótico activo en esas células y que puede reemplazarle con su propia información posicional. Esto sucede, por ejemplo, en la mutación Bithorax de Drosophila. Las mutaciones que hacen que se exprese un gen homeótico en una posición incorrecta provocan también la aparición de transformaciones homeóticas. Así se originan la mutación antennapedia en las moscas adultas, cuando se activa este gen en la cabeza, lugar en el que este gen debe estar inactivo.
Genes Hox en diversos organismos modelo
Genes Hox en Drosophila melanogaster
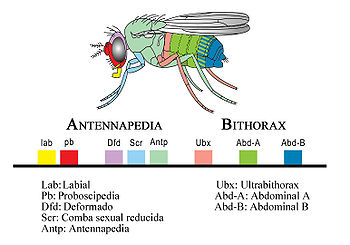
Los genes homeóticos en Drosophila melanogaster están agrupados en dos complejos situados en un mismo cromosoma, el cromosoma 3. El primero de ellos es el complejo Antennapedia que regula el desarrollo de la cabeza y de los segmentos torácicos anteriores de la mosca adulta. El segundo es el complejo Bithorax que incluye genes que regulan los segmentos abdominales y torácicos posteriores de la mosca adulta. Ambos están separados por aproximadamente 8 megabases. Al conjunto de estos dos complejos se denominó inicialmente complejo HOM-C. La separación del complejo homeótico de Drosophila en estos dos segmentos es una condición adquirida para la mosca de la fruta ya que insectos de constitución más simple tienen un cluster intacto, como sucede en Schistocerca, Tribolium o Anopheles.
El complejo Antennapedia consta de cinco genes: Labial (lab), Proboscipedia (pb), Deformado (dfd), Comba sexual reducida (Scr) y Antennapedia (Antp). Los genes homeóticos del complejo Bithorax son tres: Ultrabithorax (Ubx), Abdominal-A (Abd-A) y Abdominal B (Abd-B).
El orden de estos genes refleja su orden de expresión en el cuerpo de la mosca. En el extremo 3’ de la cadena de ADN se encuentra el gen Labial, y se expresa en la cabeza. El gen situado más a la derecha, el Abdominal-B se expresa al final del abdomen de la mosca. Mientras la colinealidad espacial es evidente, la temporal no es aparente puesto que los genes Hox de la mosca se activan casi simultáneamente durante la etapa de blastodermo y la embriogénesis es muy rápida.
Caenorhabditis elegans fue el primer organismo pluricelular al que se le secuenció completamente el genoma. Posee seis pares de cromosomas. En este nematodo se han encontrado seis genes Hox. Representan un grupo reducido de genes Hox que resulta de pérdidas de genes dentro del linaje de los nematodos. Los seis genes de C. elegans no existen como un cluster contiguo. Hay tres pares de genes distribuidos en un fragmento de 6,5 Mb con numerosos genes no homeóticos entre ellos.Genes Hox en Branchiostoma (Anfioxo)
Branchiostoma es un pariente primitivo de los vertebrados. Posee solo 14 genes Hox en un solo cluster. La organización genómica de este único complejo es similar a la que presenta la mayoría de los vertebrados, como sucede con los cuatro complejos Hox que muestran los mamíferos. Contiene al menos los diez primeros grupos homólogos de los genes Hox de los vertebrados en una disposición colineal. Esta organización es compatible con la idea que Branchiostoma es un representante vivo de un estadio intermedio crítico en la evolución de los complejos Hox. Branchiostoma tiene un gen Hox extra, el AmphiHox14m que no tiene su contrapartida en vertebrados.
Genes Hox en Mus musculus
El ratón (Mus musculus) tiene cuatro complejos de genes Hox llamados HoxA, HoxB, HoxC y HoxD. Éstos se localizan en distintos cromosomas, concretamente, los cromosomas 6, 11, 15 y 4. Estos genes Hox son homólogos a los de Drosophila, y al igual que en ésta, se agrupan en localizaciones concretas en orden 3’- 5’ dentro de los cromosomas, lo que indican un orden de expresión de anterior a posterior. Existen más genes Hox en el extremo 5’ en el ratón que en Drosophila. Esto es debido a que las moscas no poseen nada homólogo a una cola de cordado.
Para el desarrollo apropiado de los distintos segmentos en el ratón es necesaria la combinación de los productos de los genes Hox de cada uno de los cuatro complejos. Esto explica por qué las mutaciones homeóticas en los vertebrados son tan difíciles de ver. Mientras que en las moscas cuando un gen se muta da un efecto observable, en el ratón se debe eliminar simultáneamente de dos a cuatro genes para conseguir una transformación homeótica completa similar.
Genes ParaHox
El complejo ParaHox se originó a partir de la duplicación y la evolución posterior de genes Hox. Se considera parálogo de este complejo y se halla restringido a cefalocordados y vertebrados.
El complejo ParaHox posee tres genes que están muy ligados en el genoma de Branchiostoma. Se descubrieron en esta especie y se han localizado en mamíferos. Éstos son Cdx (homeobox tipo caudal), Gsh (genomic screened homebox) y Xlox/lpf1 (Xenopus laevis homeobox 8/insuline promotor factor 1). Estos genes presentan tanto colinealidad espacial como temporal. Sin embargo, la colinearidad temporal está invertida con respecto al cluster Hox, es decir, el gen Cdx posterior se activa en primer lugar en el endodermo posterior, seguidos del Xlox y el Gsh.
Los productos de los genes ParaHox se encuentran principalmente en los tejidos derivados del endodermo. En vertebrados, los genes Cdx están expresados en la región más caudal del embrión y Cdx1 y Cdx2/3 son importantes en procesos tempranos de morfogénesis intestinal. El gen Parahox central Xlox/lpf1 también se expresa en el endodermo de los cordados. Es crucial durante el desarrollo embrionario y para la diferenciación del páncreas endocrino y del duodeno anterior.
Genes NK
En 1989 Kim y Niremberg describieron utilizando una sonda con desoxirribonucleótidos que codificaban un homeodominio la presencia de cuatro nuevos genes homeóticos en Drosophila melanogaster a los que, en conjunto, denominaron con la inicial de sus nombre. Tres de ellos, NK1, NK3 Y NK4, se localizan en el cromosoma 3, mientras que el gen NK2 está situado en el cromosoma 1. Posteriormente estos genes fueron renombrados para reflejar los alelos mutados que representaban. A NK1 se llamó slouch; a NK2 se le llamó vnd (ventral nervous system defective); a NK3, bap (bagpipe) y a NK4, msh2 (muscle-specific homeobox 2) o tin (tinman, nombre tomado del hombre de hojalata sin corazón de El mago de Oz) dado que este último controla el desarrollo del corazón en Drosophila y en mamíferos. Posteriormente se aislaron más genes NK hasta llegar a un total de nueve. Los restantes se denominaron NK5, Lbe, Lbl, Msx y Tlx. En Drosophila, seis de estos genes (tin, bap, lbl, lbe, C15 y slou) se encuentran físicamente agrupados en un fragmento de 180 Kb.
Los genes NK tienen sus ortólogos en cordados. Se ha indetificado genes NK en el anfioxo y en vertebrados aunque están separados en el genoma. En la especie humana también aparecen genes NK relacionados con los de Drosophila. Así, los genes humanos NKX3.1 y NKX3.2 son ortólogos del gen bap y los genes LBX1 y LBX2 son ortólogos del gen ladybird y los genes NKX2.3, NKX2.5 y NKX2.6 lo son del tin de la mosca de la fruta.
En los genes NK el patrón evolutivo ha sido diferente al de los complejos de genes Hox y ParaHox. Mientras éstos últimos se han mantenido agrupados en el anfioxo y en los vertebrados, en Drosophila se han separado. Por el contrario, los NK han permanecido agrupados en la mosca y se han separado en los otros organismos.
Evolución de los genes homeóticos en animales
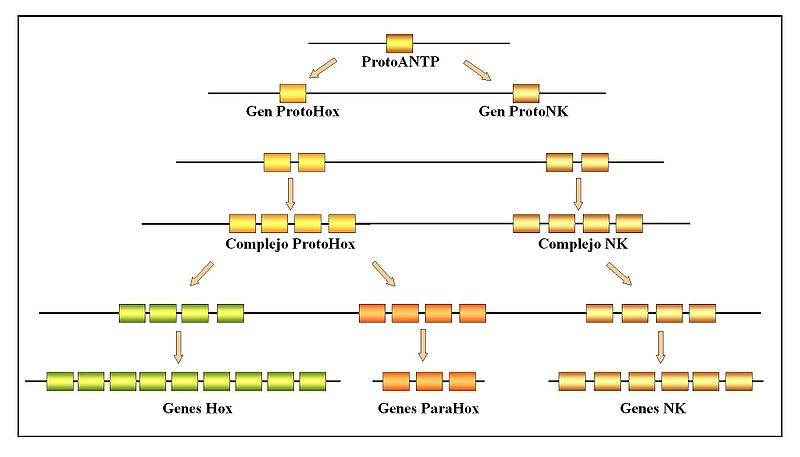
Con respecto al origen de los genes homeóticos se ha propuesto que al comienzo de la evolución de los metazoos hubo un gen homeobox fundador llamado ProtoANTP o Protoantennapedia que por cisduplicación (duplicaciones que dan lugar a dos genes situados sobre el mismo cromosoma, uno a continuación del otro) dio lugar a dos genes, el Protohox y el ProtoNK. Cada uno sufrió sucesivas amplificaciones por cisduplicación dando lugar a un megacomplejo que al final se fragmentó en los tres complejos; Hox, ParaHox y NK. Este megacomplejo debió estar ya presente antes de la separación de cnidarios y organismos con simetría bilateral.
El complejo ParaHox habría surgido de una duplicación del ProtoHox, probablemente con cuatro genes, de los que se perdería uno en el complejo ParaHox. Este cluster no habría aumentado de tamaño o incluso habría desaparecido en muchos linajes a lo largo de la evolución. Otra hipótesis señala que el complejo ProtoHox pudo ser más pequeño, con sólo dos o tres genes. El complejo Hox ha mantenido su integridad, mientras que los ParaHox y NK se han mantenido agrupados solo en algunos linajes.
Jordi Garcia-Fernàndez ha propuesto que es posible que la formación de estos tres complejos hubiera estado ligada al origen de las tres hojas blastodérmicas que desarrollan diferentes especificidades funcionales: ectodermo para el recubrimiento corporal y las funciones de relación en los sentidos y el sistema nervioso; el endodermo para el procesamiento del alimento y el mesodermo para la locomoción, circulación, excreción, etc. Así los genes Hox se expresan sobre todo en el ectodermo y neuroectodermo, contribuyendo al desarrollo del sistema nervioso central de los vertebrados. Los genes del complejo NK contribuyen a establecer patrones en el mesodermo, especialmente en Drosophila y son fundamentales para el desarrollo del corazón en los vertebrados. Por último, los genes ParaHox se expresan sobre todo en el endodermo posterior y medio. Considerando los genes Hox, es probable que los metazoos más primitivos tuvieran solo cuatro genes en este complejo. En los cnidarios solo hay dos genes. Por sucesivas cisduplicaciones de los cuatro genes primitivos se originaría el patrón probablemente compartido por los bilaterales primitivos, de los que se originaron protóstomos y deuteróstomos. Este patrón consistiría en un número variable de genes Hox comprendido entre 7 y 9, número que se estabiliza en 8 en la mayor parte de los protóstomos. En los deuteróstomos este número se habría expandido hasta 12 o 14.
En invertebrados hay un solo complejo Hox, que en Drosophila se encuentra dividido en dos, el Antennapedia y el Bithorax. Se supone que el antepasado común de todos los cordados debía de tener un cluster único también.
El cluster inicial del antepasado de los cordados pudo tener 13 genes. Esta arquitectura está aún presente en el cefalocordado Branchiostoma (anfioxo). En vertebrados, este complejo ha podido sufrir una serie de transduplicaciones (duplicaciones que dan lugar a conjuntos de genes situados en distintos cromosomas) hasta dar lugar a los cuatro complejos que los caracterizan, el HoxA, HoxB, HoxC y HoxD. Éstos podrían haber tenido un máximo de 52 genes, de los que se habrían perdido algunos. Así en los mamíferos hay sólo 39 genes. En los peces teleósteos se han producido aún más transduplicaciones, llegando a la cifra de 14 complejos.
Diversos estudios muestran que el complejo D es el más antiguo; aparecería después del A, mientras que los B y C son los más modernos. Estas transduplicaciones se habrían producido de modo paralelo a cómo ha tenido lugar el incremento en la complejidad del plan corporal durante la evolución de los vertebrados.
Genes homeóticos en plantas: las cajas MADS
Al igual que en los animales, los genes homeóticos también juegan un papel fundamental en el desarrollo de las plantas. Los cambios homeóticos fueron estudiadas en Arabidopsis por Meyerowitz y colaboradores quienes observaron mutaciones en estas plantas que afectaban a la estructura de la flor.
La forma silvestre de esta planta posee cuatro sépalos, cuatro pétalos blancos, seis estambres (cuatro largos y dos más cortos) y dos carpelos fusionados. Los mutantes de clase A tenían carpelos en lugar de sépalos y estambres en lugar de pétalos; los otros verticilos eran normales. Los mutantes de clase B tenían sépalos en el primero y segundo verticilo y carpelos en el tercero y el cuarto. El grupo C tenían sépalos y pétalos en su posición normal, y pétalos en el tercero y sépalos en el cuarto.
Meyerowitz y colaboradores concluyeron que cada clase de mutantes carecía del producto de un gen o de un grupo de genes necesarios para el desarrollo adecuado de la flor. Los mutantes de la clase A carecían de la actividad de los genes A; los de clase B de los genes B y los de clase C de los genes C. De modo semejante a como los genes homeóticos de los animales se expresaban en distintos segmentos, propusieron que los genes de clase A tenían actividad en el primer y el segundo verticilos, los B en el segundo y el tercero y los C en el tercero y el cuarto. Los productos de los genes A hacían que el primer verticilo se diferenciase a sépalos. Los productos de los genes de clase A junto con los B hacían que el segundo verticilo se diferenciara a pétalos. Los genes C y B inducían al tercer verticilo a formar estambres. Los genes C hacían que el cuarto verticilo formara carpelos.
En estudios posteriores se aislaron los genes de cada clase. Hay dos genes de clase A (APETALA 1 y APETALA 2), dos de clase B (APETALA 3 y PISCILATA) y uno de clase C (AGAMOUS). La clonación y secuenciación de estos genes demostró que son genes que funcionan como factores de transcripción cuyos productos afectan a la expresión de otros. Estos contienen unas secuencias específicas, las denominadas cajas MADS, que tienen un papel similar al de las cajas homeóticas de los animales, aunque ambos grupos de genes no son homólogos.
Los genes homeóticos de las plantas regulan el desarrollo de las estructuras de las flores, donde controlan la transición del crecimiento vegetativo al generativo y determinan la identidad del meristemo en la inflorescencia. Los productos de las distintas clases de genes homeóticos interactúan para determinar la formación de los cuatro verticilos que constituyen la flor completa.
Genes homeóticos en el hombre. Enfermedades
En humanos existen 39 genes Hox localizados en cuatro clusters que se encuentran los cromosomas 2, 7, 12 y 17. Al igual que en Drosophila, las mutaciones en los genes homeóticos de humanos provocan una serie de afecciones y síndromes que se describirán a continuación.
Hipervitaminosis A durante el embarazo
La vitamina A causa la expresión de los genes Hox 1-4 en grupos de células que habitualmente no expresan estos genes. El ácido retinoico, un derivado de la vitamina A presenta también un efecto teratogénico. Las altas dosis de este compuesto, que es empleado como tratamiento contra el acné, durante las primeras fases del embarazo de la mujer pueden alterar la regulación de los genes Hox en el embrión humano y causar graves malformaciones. Las anomalías más frecuentes son el labio leporino y malformaciones del cuello y de la cabeza. Otras alteraciones son malformaciones severas congénitas como hidrocefalia, lesiones en la columna vertebral y enfermedades cardíacas.
Los efectos de la hipervitaminosis fueron estudiados sobre Mus musculus. Cuando a las hembras gestantes se les trataba con dosis de ácido retinoico superiores a las normales, aparecían malformaciones congénitas. Éstas eran deformaciones en el esqueleto, traducidos en la pérdida de vértebras e incluso de la región posterior del cuerpo, si las dosis eran muy elevadas.
Síndrome de Waardenburg
El síndrome de Waardenburg está causado por un defecto en un gen homeótico. Es una enfermedad muy rara que afecta a uno de cada 42.000 niños nacidos. Sus principales síntomas son sordera, defectos en el esqueleto facial y una pigmentación alterada del iris.
Aniridia
La aniridia es una mutación humana en la cual se pierde el iris y la retina es hipoplásica en heterocigotos. En homocigotos hay letalidad fetal y pérdida completa de los ojos o del epitelio olfatorio. La pérdida del iris del ojo parece estar causada por un defecto en el gen homeótico PAX 6. Es una enfermedad congénita rara. Si éste gen está alterado, el resultado es un niño que carece de iris. Si no hay iris en el ojo es imposible controlar la entrada de luz. La única solución es el empleo de lentes coloreadas para reducir la entrada de luz en el ojo.
Megacolon
En Mus musculus se ha demostrado que la alteración de determinados genes homeóticos provoca una malformación del colon llamada megacolon. Esta condición implica un agrandamiento de determinadas partes del colon. En niños pequeños se ha diagnosticado casos de megacolon con origen desconocido que pudieran deberse a alteraciones en genes homeóticos aunque se están investigando.
Costillas extra
La aparición de costillas extras en la región del cuello, adheridas a la séptima vértebra cervical es otro ejemplo de alteración debido a mutaciones en los genes homeóticos. Esta alteración ocurre con cierta frecuencia en las poblaciones humanas y no suele ser deletérea.
Síndrome mano-pie-genital
Es una enfermedad hereditaria dominante causada por una mutación de tipo nonsense que altera el gen HoxA13 en el segmento de unión al ADN. Los varones presentan hipospadias y en las hembras defectos en la pared del útero, al igual que malformaciones uretrales. Estas afecciones se solucionan mediante cirugía. Otra característica que presenta es que los pulgares y el dedo gordo del pie están acortados.
Cardiopatías congénitas
Algunas anomalías cardiacas congénitas está causadas por una mutación del gen NKX2.5, el cual se encuentra en el cromosoma 5. Éste es el gen tinman de los humanos, previamente estudiado en Drosophila. Unos de los síntomas que presenta esta mutación es la presencia de un orificio que comunica el corazón izquierdo con el derecho. Este tipo defecto provoca que el corazón trabaje con más carga de la normal, que haya un flujo anormal de la sangre y que la sangre oxigenada se mezcle con la desoxigenada. La solución para este tipo de alteraciones es la cirugía.
Bibliografía
- Brady, G. (2000). «Hox genes : 'The Molecular Architects'». The Irish Scientist. http://www.irishscientist.ie/2000/contents.asp?contentxml=156s.xml&contentxsl=insight3.xsl.
- De Robertis, E.M., Oliver, G. y Wright, C.V.E. (1996). «Genes con homeobox y el plan corporal de los vertebrados». Investigación y Ciencia. Temas 3. páginas 92-99.
- Garcia-Fernàndez, J. (2005). «Hox, ParaHox, ProtoHox: facts and guesses». Heredity 94: pp. 145-152. http://www.nature.com/hdy/journal/v94/n2/full/6800621a.html.
- Garcia-Fernàndez, J. (2005). «The genesis and evolution of homeobox gene clusters». Nature reviews Genetics 6. páginas 881-892.
- Kim, Y. & Nirenberg, M. (1989). «Drosophila NK-homeobox genes». Proc. Natl. Acad. Sci. 86. páginas 7716-7720. http://www.pnas.org/content/86/20/7716.full.pdf+html.
- Luke, G.N., Castro, F.C., McLay, K., Bird, C., Coulson, A. y Holland, P.W.H. (2003). «Dispersal of NK homeobox gene clusters in amphioxus and humans». Proc. Natl. Acad. Sci 100 (9). páginas 5292-5295. http://www.pnas.org/content/100/9/5292.full.
- McGinnis, W. y Kuziora, M. (1996). «Arquitectos moleculares del diseño corporal». Investigación y Ciencia. Temas 3. páginas 112-118.
- Meyer, Axel (1998). «Hox gene variation and evolution». Nature 391 (15): pp. 225-228. http://www.nature.com/nature/journal/v391/n6664/full/391225a0.html.
- Muñoz-Chápuli, R. (2007). «El origen y evolución de los complejos homeobox». Encuentros en la Biología 115. http://www.encuentros.uma.es/encuentros115/homeobox.htm.
- Pierce, B. A. (2009). Genética. Un enfoque conceptual. Editorial Médica Panamericana.
- Theissen G (2001). «Development of floral organ identity: stories from the MADS house». Curr. Opin. Plant Biol. 4 (1): pp. 75–85. http://linkinghub.elsevier.com/retrieve/pii/S1369-5266(00)00139-4.
- Young T, Rowland JE, van de Ven C, et al. (octubre 2009). «Cdx and Hox genes differentially regulate posterior axial growth in mammalian embryos». Dev. Cell 17 (4): pp. 516–26. doi:.
Enlaces externos
Wikimedia foundation. 2010.