- Desarrollo floral
-
El desarrollo floral o desarrollo de la flor es el proceso por el cual las plantas angiospermas producen un patrón de expresión génica característico en un meristemo que conduce a la aparición de un órgano orientado a la reproducción sexual, la flor. Para ello, deben producirse tres acontecimientos fisiológicos: primero, la transición de la planta inmadura sexualmente hacia el estado maduro (es decir, la transición hacia la floración); segundo, la transformación del destino del meristemo vegetativo hacia un meristemo de la flor o inflorescencia; y, finalmente, la arquitectura de los distintos órganos de la flor. Respecto de este último paso, se ha descrito un modelo, conocido como modelo ABC, que intenta explicar desde la perspectiva de la genética molecular y del desarrollo la base biológica de dicho proceso.
Para que se inicie la diferenciación del meristemo hacia una flor es precisa la existencia de un estímulo exógeno que active la división mitótica del meristemo, especialmente en sus laterales, donde se generan los nuevos primordios. Además, dichos meristemos, debido a este estímulo, siguen una pauta de desarrollo conducente a generar meristemos florales, y no meristemos vegetativos; la principal diferencia con éstos, además de la evidente disparidad en el órgano objetivo, es la filotaxia verticilada, es decir, la ausencia de elongación del tallo entre los sucesivos verticilos del primordio. Dichos verticilos, siguiendo un desarrollo acropétalo, dan lugar a los sépalos, pétalos, estambres y carpelos. Además, otra diferencia con los meristemos vegetativos axilares es que el floral está «determinado», lo que significa que, una vez diferenciadas, sus células no se van a dividir más.[1]
La identidad de los órganos presentes en los cuatro verticilos florales es consecuencia de la interacción de al menos tres tipos de productos génicos de funciones distintas. Según el modelo ABC, las funciones A y C, se requieren, respectivamente, para determinar la identidad de los verticilos del periantio y de los verticilos reproductivos. Ambas funciones serían excluyentes, y, la ausencia de una de ellas, provocaría que la otra función pasara a determinar la identidad de todos los verticilos de la flor. La existencia de la función B permitiría diferenciar la identidad de pétalos de la identidad de sépalos en el verticilo segundo, así como la identidad de estambres de la identidad de carpelos en el tercer verticilo.
El concepto de flor de acuerdo a la «teoría foliar», que sugiere que todas las piezas florales son hojas estructuralmente modificadas y funcionalmente especializadas en la reproducción o la protección, fue formulado ya en el siglo XVIII. En 1790 cuando Goethe publicó su obra "Un intento para interpretar la metamorfosis de las plantas" ("Versuch die Metamorphose der Pflanzen zu erklaren").[2] En este libro, que consistía en 123 párrafos numerados, Goethe escribió:
"...también deberíamos decir que un estambre es un pétalo contraído, como que un pétalo es un estambre en expansión; o que el sépalo es una hoja caulinar contraída aproximándose a cierto estado de refinamiento, como que una hoja caulinar es un sépalo expandido por el influjo de jugos más bastos".[3]Contenido
Transición floral
La transición desde la fase vegetativa hacia una fase reproductiva supone un cambio drástico en el ciclo vital de una planta, quizá el más importante, pues su correcto desarrollo es imprescindible para garantizar la generación de descendencia. Dicho salto se caracteriza por la inducción y desarrollo de un meristemo de la inflorescencia, que generará conjuntos de flores, o de una flor, en el caso de que éstas sean solitarias. El mencionado cambio morfogenético posee tanto elementos endógenos como exógenos: por ejemplo, existen requisitos de número de hojas o de biomasa total, para iniciar el proceso, pero también se exigen determinadas condiciones ambientales, como puede ser un fotoperiodo característico. Evidentemente, los reguladores vegetales, las fitohormonas, intervienen en el proceso, destacándose por su importancia el papel de las giberelinas.[4]
Existen multitud de rutas de transducción de señales que modulan la biología molecular del proceso. No obstante, cabe resaltar, en la planta modelo Arabidopsis thaliana, el papel de los siguientes tres genes: FLOWERING LOCUS T (FT), LEAFY (LFY), SUPPRESOR OF OVEREXPRESSION OF CONSTANS1 (SOC1, también llamado AGAMOUS-LIKE20).[5] Estos genes poseen funciones tanto comunes como independientes en la transición floral. SOC1 es un gen tipo MADS-box, e integra las respuestas frente a fotoperiodo, vernalización y giberelinas.[4]
Formación del meristemo floral o de la inflorescencia
Se define meristemo como aquel tejido o grupo de tejidos de una planta que albergan a células madre, indiferenciadas por tanto, capaces de dar lugar a cualquier tipo de tejido. Su desarrollo y mantenimiento, ya en los meristemos de la inflorescencia, ya en los vegetativos, está regido por circuitos de control genético del destino celular. De este modo, varios genes regulan, por ejemplo, el mantenimiento del carácter de célula madre (gen WUSCHEL o WUS), si bien otros actúan mediante retroalimentación negativa inhibiendo dicho carácter (gen CLAVATA o CLV); ambos, de este modo, dan lugar a un bucle de retroalimentación que proporciona, junto a otros elementos, gran robustez al sistema.[6] Junto a WUS interviene otro gen, SHOOTMERISTEMLESS (STM), que reprime la diferenciación en el propio domo meristemático, inhibiendo la posible diferenciación de las células madre pero permitiendo su división en células hijas que sí que se diferenciarán, dando lugar a los distintos órganos.[7]
Arquitectura de la flor
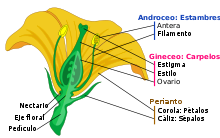
La anatomía de la flor, definida por la presencia de una serie de órganos (sépalos, pétalos, estambres, carpelos) situados según una determinada pauta, permite a las fanerógamas la reproducción sexual. Dicha estructura emana de la actividad de tres clases de genes que regulan el desarrollo floral: los genes de identidad de meristemo, los genes de identidad de órgano floral y los genes cadastrales.[8]
- Genes de identidad de meristemo. Codifican para factores de transcripción necesarios para iniciar la indución de los genes de identidad. Son reguladores positivos de la identidad de órgano durante el desarrollo floral.
- Genes de identidad de órgano. Controlan directamente la identidad de órgano. Codifican también para factores de transcripción que controlan la expresión de otros genes cuyos productos están implicados en la formación o función de los distintos órganos de la flor.
- Genes cadastrales. Son aquéllos que actúan como reguladores espaciales de la actividad de los genes de identidad de órgano, dando lugar a fronteras en su expresión. De este modo, se controla la interferencia o no entre genes que no deben intervenir en el mismo lugar y momento.
El modelo ABC
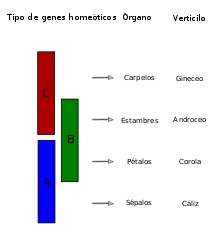 Representación gráfica del modelo ABC; la expresión única o aditiva de los genes homeóticos de la columna de la izquierda repercute en el desarrollo de órganos, en el centro, y determina la naturaleza del verticilo, a la derecha.
Representación gráfica del modelo ABC; la expresión única o aditiva de los genes homeóticos de la columna de la izquierda repercute en el desarrollo de órganos, en el centro, y determina la naturaleza del verticilo, a la derecha.
El modelo ABC del desarrollo floral fue propuesto como modelo explicativo del conjunto de mecanismos genéticos que dan lugar al establecimiento de identidades de órgano en Arabidopsis thaliana, como representante de las Rósidas, y de Antirrhinum majus, perteneciente al linaje de las Astéridas. Ambas especies poseen cuatro verticilos (sépalos, pétalos, estambres y carpelos), definidos por la expresión diferencial en cada verticilo de una serie de genes homeóticos. De este modo, los sépalos se caracterizan por la expresión de genes A exclusivamente; en los pétalos, en cambio, se coexpresan los genes A y B; en los estambres, los genes de función B y C establecen su identidad; y en los carpelos, únicamente se requiere de la actividad de genes de función C. Además, los genes tipo A y C son antagonistas recíprocos.[9]
El hecho de que estos genes homeóticos determinan la identidad de órgano se pone de manifiesto cuando un gen representante de una determinada función, por ejemplo la A, no se expresa: así, en Arabidopsis dicha pérdida produce la aparición de una flor compuesta por un verticilo de carpelos, otro de estambres, otro de estambres, y otro de carpelos.[9] Esta metodología de estudio de la función de los genes, acorde con la genética inversa, se consigue habitualmente generando plantas transgénicas que alberguen una construcción de silenciamiento génico mediante ARN de interferencia. En otros casos, según un abordaje de genética directa, es el análisis de fenotipos de flores de estructura anómala (que poseen un alelo no funcional o sobreexpresado para el mencionado gen) que conduce, mediante técnicas de cartografía genética, al la clonación del gen de interés.[10]
Se ha propuesto, además de las mencionadas funciones A, B y C, la existencia de unas suplementarias: la D y la E. La función D especificaría la identidad de óvulo, como una función reproductiva separada del desarrollo de los carpelos y posterior en aparición a la determinación de éstos.[11] La función E correspondería a un requisito fisiológico propio de todos los verticilos florales, aunque, en inicio, fue descrita como necesaria para el desarrollo de los tres verticilos más internos (función E sensu stricto).[12] No obstante, su acepción sensu lato sugiere que es requerido en los cuatro verticilos.[13] De este modo, cuando se pierde la función D, los óvulos pasan a ser estructuras semejantes a hojas, y cuando se pierde la función E sensu stricto, los órganos florales de los tres verticilos más internos se transforman en sépalos,[12] mientras que, de perderse la función E sensu lato, todos los verticilos son semejantes a hojas.[13] Es interesante recalcar que los productos génicos de los genes de función D y E son también genes MADS-box.[14]
Algunos genes implicados en el desarrollo floral[15] [16] A. majus A. thaliana P. hybrida Función A SQUAMOSA (SQUA) APETALA2 (AP2) APETALA1 (AP1) PhAP2A, PhAP2C, PhAP2C Función B DEFICIENS (DEF) GLOBOSA (GLO) APETALA3 (AP3) PISTILLATA (PI) PhGLO1, PhGLO2 (=PMADS2 o FBP3), PhDEF, PhTM6 Función C PLENA (PLE) FARINELLI (FAR) AGAMOUS (AG) pMADS3, FBP6 Análisis genético
La estrategia de estudio del desarrollo floral contó con: primero, la identificación de genes precisos para determinar la identidad del meristemo floral, como, en A. thaliana, APETALA1 (AP1) y LEAFY (LFY); y segundo, el análisis genético de los fenotipos aberrantes para los caracteres relativos a las flores, lo que permitió caracterizar los genes homeóticos implicados en el proceso.
Análisis de mutantes
Existen multitud de mutaciones que afectan a la morfología floral; no obstante, su análisis es muy reciente. Una de las evidencias de dichas mutaciones es que gran parte afecta a la identidad de los órganos florales. Es decir, unos órganos se desarrollan en el lugar en el que deberían hacerlo otros: a este hecho se denomina mutación homeótica, por analogía con las mutaciones caracterizadas en Drosophila. En Arabidopsis y Antirrhinum, los dos taxones modelo empleados, estas mutaciones siempre afectan a verticilos adyacentes. De esta forma, se caracterizan tres clases de mutaciones, según los verticilos afectados:
- Mutaciones en genes de función A, que afectan al cáliz y corola, los verticilos más externos. En estos mutantes, como APETALA2 de A. thaliana, diferencian carpelos en lugar de sépalos, y estambres en lugar de pétalos; es decir, los verticilos del periantio se transforman en verticilos reproductivos.
- Mutaciones en genes de función B', que afectan a la corola y a los estambres, los verticilos intermedios. Se han descrito dos mutantes en A. thaliana, APETALA3 y PISTILLATA, que diferencian sépalos en vez de pétalos y carpelos en lugar de estambres.
- Mutaciones en genes de función C, que afectan a los verticilos reproductivos, esto es, a los estambres y carpelos. El mutante en A. thaliana para este grupo se denomina AGAMOUS, que posee un fenotipo de cambio de identidad de estambres a pétalos y de carpelos a sépalos.
Técnicas de detección de la expresión diferencial
Se ha clonado el ADN de los genes asociados a funciones homeóticas afectados en los mutantes descritos; de este modo, el análisis de su expresión a lo largo del desarrollo de la flor muestra patrones de expresión tisular, que, en general, se corresponden con los predichos por el modelo ABC.
La naturaleza de dichos genes corresponde a la de factores de transcripción, como era de esperar; su estructura es análoga a la de una familia de factores de levaduras y células animales denominada familia MADS (el término es un acrónimo de los distintos factores descritos). Dichos factores MADS se han detectado en todas las especies vegetales investigadas, si bien no se descarta la implicación de otros elementos de regulación de la expresión génica.[8]
Genes de función A
En A. thaliana, la función A está representada principalmente por dos genes, APETALA1 (AP1) y APETALA2 (AP2)[17] Ap1 es un gen tipo MADS-box, mientras que AP2 es un representante de la familia de genes con dominio AP2, a la cual dio su nombre, que consta de factores de transcripción específicos de plantas.[18] AP1 interviene como gen de función A, por tanto en la identidad de sépalos y pétalos, pero también interviene en el propio meristemo floral. AP2 se expresa no sólo en los dos primeros verticilos, sino en los dos restantes, en óvulos en desarrollo e incluso en hojas, luego es posible que exista una regulación postranscripcional que controle su función A, o bien que posea otros fines independientemente de la mencionada función en la determinación de la identidad del órgano.[18]
En Antirrhinum, el gen ortólogo a AP1 es SQUAMOSA (SQUA), que también posee especial impacto en la identidad del meristemo floral. Los homólogos para AP2 son LIPLESS1 (LIP1) y LIPLESS2 (LIP2), de función redundante y especial interés en el desarrollo de sépalos, pétalos y óvulos.[19]
En Petunia hybrida se han descrito tres genes semejantes a AP2, a saber: P. hybrida APETALA2A (PhAP2A), PhAP2B Y PhAP2C. PhAP2A posee una alta homología con AP2 de Arabidopsis, tanto en secuencia como en pauta de expresión, lo que sugiere que se trata de ortólogos. PhAP2B y PhAP2C son, en cambio, proteínas ligeramente distintas, si bien pertenecen a la familia de factores de transcripción semejantes a AP2; además se expresan de forma divergente, aunque cerca de ser complementaria, comparadas a PhAP2A. De hecho, los mutantes para estos genes no ofrecen el fenotipo acostumbrado, el propio de los alelos nulos de genes de función A.[20] No obstante, se conoce un mutante de función A en Petunia desde hace tiempo, mutante denominado blind (bl), si bien su gen no se ha clonado aún.[20]
Genes de función B
En A. thaliana la función B emana principalmente de dos genes, APETALA3 (AP3) y PISTILLATA (PI), ambos de naturaleza MADS-box. Una mutación en uno de estos genes ya provoca la conversión homeótica de los pétalos en sépalos y de los estambres en estructuras carpeloides.[21] Esto también sucede en sus ortólogos de A. majus, que son DEFICIENS (DEF) y GLOBOSA (GLO).[22] Para el caso de ambas especies la forma activa de unión al ADN es la derivada del heterodímero: es decir, AP3 y PI, o DEF y GLO, dimerizan y, entonces, son capaces de efectuar su función.[23]
En Petunia se ha producido una duplicación de los linajes GLO/PI: de este modo, posee P. hybrida GLOBOSA1 (PhGLO1, también llamada FBP1) pero también PhGLO2 (sinónimo de PMADS2 o FBP3). En cuanto a los elementos de función equivalente a AP3/DEF, en Petunia se da tanto un gen que posee una secuencia relativamente semejante, llamada PhDEF, como un gen de función B atípico, denominado PhTM6. De acuerdo a los estudios de filogenética, los tres primeros se enmarcan dentro de un linaje «euAP3» mientras que PhTM6 pertenece al «paleoAP3».[24] Cabe destacar que la aparición del linaje euAP3 parece estar relacionado, en cuanto a historia evolutiva, con la radiación de dicotiledóneas, puesto que los representantes de clase B de tipo euAP3 están presentes en dicotiledóneas mientras que los paleoAP3 lo están en monocotiledóneas y angiospermas basales, entre otras.[25]
En las angiospermas eudicotiledóneas los órganos florales, como ha sido descripto previamente, se hallan dispuestos en 4 verticilos diferentes, los que contienen los sépalos, los pétalos, los estambres y los carpelos. De acuerdo con el modelo ABC, la identidad de estos órganos está especificada por los genes homeóticos de la clase A, A+B, B+C y C, respectivamente. En contraste con los verticilos de sépalos y pétalos de las eudicots, el perigonio de muchas plantas de las Liliáceas presenta dos verticilos externos de órganos petaloides casi idénticos entre sí (los tépalos). Para explicar la morfología floral de las Liliáceas, van Tunen y colaboradores en 1993 propusieron un modelo ABC modificado. De acuerdo con este modelo, los genes de la clase B no se expresan solamente en el verticilo 2 y 3, sino también en el 1. Se sigue, entonces, que los órganos de los verticilos 1 y 2 expresan genes de la Clase A y de la Clase B y, de ese modo, logran su identidad petaloide. Este modelo teórico se ha comprobado empíricamente a través del clonado y caracterización de los homólogos de los genes de Antirrhinum GLOBOSA y DEFICIENS de una Liliácea, el tulipán (Tulipa gesneriana), los cuales se expresan en los verticilos 1, 2 y 3.[26] En otra especie filogenéticamente distanciada de los organismos modelo, como Agapanthus praecox ssp. orientalis (Agapanthaceae), también se han aislado y caracterizado los homólogos GLOBOSA y DEFICIENS, los que fueron denominados ApGLO y ApDEF, respectivamente. Ambos contienen marcos abiertos de lectura que codifican proteínas con 210 a 214 aminoácidos. El análisis filogenético sobre esas secuencias indicó que los mismos pertenecen a la familia génica B de las monocotiledóneas. Los experimentos de hibridación in situ revelaron que ambas secuencias se expresan en el verticilo 1, como así también en el 2 y 3. Todas estas observaciones indican que el mecanismo de desarrollo floral de Agapanthus también sigue un modelo ABC modificado.[27]
Genes de función C
En A. thaliana, la función C deriva de un único gen tipo MADS-box denominado AGAMOUS (AG), que interviene tanto en el establecimiento de la identidad de estambre y carpelo como en la determinación del meristemo floral.[17] De este modo, los mutantes ag poseen flores carentes de androceo y gineceo, presentando una sustitución por pétalos y sépalos en su lugar; y no sólo eso, sino que el crecimiento en el centro de la flor es indeterminado, por lo que dichos pétalos y sépalos surgen en verticilos repetitivos.
En A. majus, el equivalente de AG es PLENA (PLE), aunque no se trata de us ortólogo; el que sí lo es es FARINELLI (FAR), que, además, está especializado en el desarrollo de las anteras y maduración del polen.[28]
En el caso de Petunia, como también sucedía en Antirrhinum o en maíz, la función C se controla de forma redundante mediante varios genes. Los que poseen mayor homología con AG en Petunia son pMADS3 y floral-binding protein 6 (FBP6).[28]
Genes de función D y E
En 1995 se descubrió una nueva familia de proteínas MADS-box con una función distinta a las descritas anteriormente, que presentaban cierta homología con los de la función C: se trata de los genes de función D. Concretamente, se vio que en Petunia intervenían en el desarrollo del óvulo, denominados FLORAL BINDING PROTEIN7 (FBP7) Y FLORAL BINDING PROTEIN1L (FBP1l).[11] Más tarde, se encontraron genes equivalentes en Arabidopsis,[29] donde también intervenían en el control del desarrollo carpelar y del óvulo, e incluso de estructuras relacionadas con la dispersión de las semillas.
La aparición de fenotipos de interés en líneas de cosupresión de Petunia y tomate condujeron en 1994 a la definición de un nuevo tipo de función en el modelo de desarrollo floral: la función E, cuya expresión sería requerida por todos los verticilos florales, aunque, en inicio, fue descrita como necesaria para el desarrollo de los tres más internos.[12]
Referencias
Textos generales
- Soltis DE, Soltis PS, Leebens-Mack J, eds. (2006). Advances in botanical research: Developmental genetics of the flower. New York, NY: Academic Press. ISBN 978-0-12-005944-7.
- Wolpert, Lewis; Beddington, R.; Jessell, T.; Lawrence, P.; Meyerowitz, E. y Smith, W. (2002). Principles of Development (Second edition edición). Oxford: Oxford University Press. ISBN 0-19-879291-3.
Citadas en el texto
- ↑ Azcón-Bieto et al. (2000). Fundamentos de fisiología vegetal. McGraw-Hill/Interamericana de España, SAU. ISBN 84-486-0258-7.
- ↑ Dornelas, M.C.; Dornelas, O. 2005. Da folha à flor: revisitando os conceitos de Goethe sobre a ¨metamorfose¨ das plantas. Braz. J. Plant Physiol., Londrina, v. 17, n. 4,
- ↑ Goethe J.W. von (1790) Versuch die Metamorphose der Pflanzen zu erklaren. Gotha, Ettlinger; párrafo 120."
- ↑ a b Miguel A. Blázqueza, Roland Greenb, Ove Nilssona, Michael R. Sussmanb,c, and Detlef Weigel. Gibberellins Promote Flowering of Arabidopsis by Activating the LEAFY Promoter Plant Cell, Vol. 10, 791-800, May 1998
- ↑ Miguel A. Blázquez and Detlef Weigel. Integration of floral inductive signals in Arabidopsis Nature 404, 889-892 (20 April 2000) | doi:10.1038/35009125
- ↑ Ulrike Brand, Jennifer C. Fletcher, Martin Hobe, Elliot M. Meyerowitz. Dependence of Stem Cell Fate in Arabidopsis on a Feedback Loop Regulated by CLV3 Activity Science 289 (5479): 617-619
- ↑ Michael Lenhard, Gerd Jürgens and Thomas Laux. The WUSCHEL and SHOOTMERISTEMLESS genes fulfil complementary roles in Arabidopsis shoot meristem regulation Development 129, 3195-3206 (2002)
- ↑ a b Taiz et Zeiger (2002). Plant pysiology. Sinauer associates. ISBN 0-87893-823-0.
- ↑ a b Bowman, J.L et al.. Expression of the Arabidopsis floral homeotic gene AGAMOUS is restricted to specific cell types late in flower development. Plant Cell 3, 749-758
- ↑ Chris Somerville and Shauna Somerville. Plant Functional Genomics. Science 16 July 1999: Vol. 285. no. 5426, pp. 380 - 383. DOI: 10.1126/science.285.5426.380
- ↑ a b L Colombo, J Franken, E Koetje, J van Went, H J Dons, G C Angenent, et A J van Tunen. The petunia MADS box gene FBP11 determines ovule identity. Plant Cell. 1995 November; 7(11): 1859–1868.
- ↑ a b c Soraya Pelaz, Gary S. Ditta, Elvira Baumann, Ellen Wisman and Martin F. Yanofsky. B and C floral organ identity functions require SEPALLATA MADS-box genes Nature 405, 200-203 (11 May 2000) | doi:10.1038/35012103
- ↑ a b Gary Ditta, Anusak Pinyopich, Pedro Robles, Soraya Pelaz and Martin F. Yanofsky. The SEP4 Gene of Arabidopsis thaliana Functions in Floral Organ and Meristem Identity Current Biology Volume 14, Issue 21, 9 November 2004, Pages 1935-1940
- ↑ Hong Ma. MOLECULAR GENETIC ANALYSES OF MICROSPOROGENESIS AND MICROGAMETOGENESIS IN FLOWERING PLANTS Annual Review of Plant Biology Vol. 56: 393-434 (doi:10.1146/annurev.arplant.55.031903.141717)
- ↑ Fosket, Donald E. (1994). Plant Growth and Development: A Molecular Approach. San Diego: Academic Press. pp. 498-509. ISBN 0-12-262430-0.
- ↑ Rijpkema A, Gerats T, Vandenbussche M. Genetics of floral development in Petunia. In: Advances in botanical research—Soltis DE, Soltis PS, Leebens-Mack J, eds. (2006) 44. New York, NY: Academic Press. 237–270. Developmental genetics of the flower.
- ↑ a b John L. Bowman, David R. Smyth and Elliot M. Meyerowitz. Genes Directing Flower Development in Arabidopsis The Plant Cell, Vol. 1, No. 1 (Jan., 1989), pp. 37-52
- ↑ a b K D Jofuku, B G den Boer, M Van Montagu, and J K Okamuro. Control of Arabidopsis flower and seed development by the homeotic gene APETALA2 Plant Cell. 1994 September; 6(9): 1211–1225.
- ↑ Emma Keck Paula McSteen Rosemary Carpenter and Enrico Coen. Separation of genetic functions controlling organ identity in flowers EMBO J. 2003 March 3; 22(5): 1058–1066. doi: 10.1093/emboj/cdg097
- ↑ a b Tamara Maes, Nancy Van de Steene, Jan Zethof, Mansour Karimi, Mariëlla D'Hauw, Gwenny Mares, Marc Van Montagu, and Tom Gerats. Petunia Ap2-like Genes and Their Role in Flower and Seed Development Plant Cell, Vol. 13, 229-244, February 2001
- ↑ J. L. Bowman, D. R. Smyth and E. M. Meyerowitz. Genes Directing Flower Development in Arabidopsis THE PLANT CELL, Vol 1, Issue 1 37-52
- ↑ H Sommer, J P Beltrán, P Huijser, H Pape, W E Lönnig, H Saedler, and Z Schwarz-Sommer. Deficiens, a homeotic gene involved in the control of flower morphogenesis in Antirrhinum majus: the protein shows homology to transcription factors EMBO J. 1990 March; 9(3): 605–613
- ↑ J L Riechmann, B A Krizek, and E M Meyerowitz. Dimerization specificity of Arabidopsis MADS domain homeotic proteins APETALA1, APETALA3, PISTILLATA, and AGAMOUS. Proc Natl Acad Sci U S A. 1996 May 14; 93(10): 4793–4798.
- ↑ Michiel Vandenbussche, Jan Zethof, Stefan Royaert, Koen Weterings and Tom Gerats. The Duplicated B-Class Heterodimer Model: Whorl-Specific Effects and Complex Genetic Interactions in Petunia hybrida Flower Development The Plant Cell 16:741-754 (2004)
- ↑ Elena M. Kramera, Robert L. Doritb, and Vivian F. Irish[Molecular Evolution of Genes Controlling Petal and Stamen Development: Duplication and Divergence Within the APETALA3 and PISTILLATA MADS-Box Gene Lineages http://www.genetics.org/cgi/content/full/149/2/765] Genetics, Vol. 149, 765-783, June 1998
- ↑ Akira Kanno, Hiroshi Saeki, Toshiaki Kameya, Heinz Saedler and Günter Theissen. 2003. [http://www.springerlink.com/content/r07l6l05337101t7/ Heterotopic expression of class B floral homeotic genes supports a modified ABC model for tulip (Tulipa gesneriana) ] Plant Molecular Biology Volume 52, Number 4.
- ↑ Toru Nakamura, Tatsuya Fukuda, Masaru Nakano, Mitsuyasu Hasebe, Toshiaki Kameya & Akira Kanno. 2005. The modified ABC model explains the development of the petaloid perianth of Agapanthus praecox ssp. orientalis (Agapanthaceae) flowers Plant Molecular Biology Volume 58, Number 3.
- ↑ a b Brendan Davies, Patrick Motte, Emma Keck, Heinz Saedler, Hans Sommer and Zsuzsanna Schwarz-Sommer. PLENA and FARINELLI: redundancy and regulatory interactions between two Antirrhinum MADS-box factors controlling flower development The EMBO Journal (1999) 18, 4023–4034, doi:10.1093/emboj/18.14.4023
- ↑ Rebecca Favaro1, Anusak Pinyopich, Raffaella Battaglia, Maarten Kooiker, Lorenzo Borghi, Gary Ditta, Martin F. Yanofsky, Martin M. Katec and Lucia Colombo. MADS-Box Protein Complexes Control Carpel and Ovule Development in Arabidopsis. The Plant Cell, Vol. 15, 2603-2611, November 2003
Enlaces externos
- Imágenes de mutantes de Arabidopsis (en inglés)
- Imágenes de mutantes de Antirrhinum (en inglés)
Categorías:- Genética del desarrollo
- Morfología de la flor
Wikimedia foundation. 2010.