- Geometría molecular angular
-
En Química, la geometría molecular angular (también llamada en forma de V) describe la disposición de los electrones en el espacio en torno a aquellas moléculas de tipo AX2E1 o AX2E2, según la VSEPR, es decir, aquellas moléculas con dos pares de electrones enlazantes y uno o dos pares no enlazantes. Debido a la existencia de numerosas moléculas con una de estas dos estructuras electrónicas, este tipo de geometría es predominante.
Contenido
Geometría del agua
El ejemplo más conocido es el de la molécula de agua (H2O). En ella, los pares de electrones sin compartir ejercen una repulsión que evita la formación de un tetraedro (109,5º), por lo que los enlaces O-H forman entre sí un ángulo de 104,5º. A nivel analítico, se puede predecir que los pares electrónicos formen 90º debido a la configuración electrónica del oxígeno (1s22s2p4), sin embargo resulta evidente la existencia de una repulsión mutua entre los propios átomos de hidrógeno, que "abren" el ángulo de enlace hasta que la fuerza de repulsión de los pares no enlazantes lo permiten.
De esta forma, se observa como la geometría molecular angular deriva de la geometría molecular tetraédrica, en tanto que las moléculas angulares tienen tan solo dos pares de electrones enlazantes, mientras que las tertraédricas tienen sus únicos cuatro pares enlazados, formando ángulos de 109,5º.
Otros ejemplos
Como se ha dicho, existen incontables ejemplos de moléculas de geometría angular, clasificados según su disposición AXE:
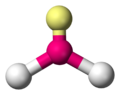
- AX2E1: tienen una estructura angular plana, por lo que todos los pares electrónicos forman ángulos de entre 100º y 120º entre sí. Destacan el ion nitrito, el dióxido de azufre, el metileno y el ozono.
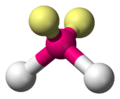
- AX2E2: siguen la estructura angular tridimensional del agua, po lo que los pares enlazantes forman entre sí ángulos mayores que 90º. Además del agua, destacan el sulfuro de hidrógeno, el difluoruro de oxígeno y el dicloruro de azufre.
Modelos gráficos
Es frecuente el empleo del modelo de representación química de bolas para mostrar las moléculas en 3D. En amarillo se muestran los pares de electrones no enlazantes.
Enlaces externos
Wikimedia foundation. 2010.