- Dióxido de azufre
-
Dióxido de azufre
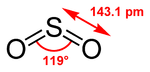
Nombre (IUPAC) sistemático Dióxido de azufre General Otros nombres Óxido de azufre (IV)
Anhídrido sulfuroso
Anhidruro del ácido sulfurosoFórmula semidesarrollada SO2 Fórmula molecular n/d Identificadores Número CAS n/d Número RTECS WS4550000 Propiedades físicas Estado de agregación Gas Apariencia Incoloro Densidad 1400 kg/m3; 1,4 g/cm3 Masa molar 64,1 g/mol Punto de fusión 198 K (–75 °C) Punto de ebullición 263 K (–10 °C) Propiedades químicas Solubilidad en agua 9,4 g en 100 g de agua Termoquímica ΔfH0gas –296,84 kJ/mol S0gas, 1 bar 248,21 J·mol-1·K-1 Peligrosidad NFPA 704 Frases R R23 R34 Frases S S1/2 S9 S26 S36/37/39 S45 Número RTECS WS4550000 Riesgos Ingestión Relativamente poco tóxico, puede causar náuseas, vómitos y esterilidad. Sin datos para exposición a largo plazo. Inhalación Irritación extrema. Piel Riesgoso comprimido y criogénico. Ojos Riesgoso comprimido y criogénico. Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl dióxido de azufre es un óxido cuya fórmula molecular es SO2. Es un gas incoloro con un característico olor asfixiante. Se trata de una sustancia reductora que, con el tiempo, el contacto con el aire y la humedad, se convierte en trióxido de azufre. La velocidad de esta reacción en condiciones normales es baja.
En agua se disuelve formando una disolución ácida. Puede ser concebido como el anhidruro de un hipotético ácido sulfuroso (H2SO3). Esto —en analogía a lo que pasa con el ácido carbónico— es inestable en disoluciones ácidas pero forma sales, los sulfitos y hidrogenosulfitos.Contenido
Preparación
El dióxido de azufre se forma en el proceso de combustión del azufre[1] y del Sulfuro de hidrógeno.
- S8 + 8 O2 → 8 SO2
- 2 H2S + 3 O2 → 2 H2O + 2 SO2
También puede obtenerse por tostación de minerales sulfurados tales como la pirita (FeS),[2] la wurtzita o la blenda (ambos ZnS),[3] la galena (PbS)[1] y el cinabrio (HgS).
- 4 FeS2 + 11 O2 → 2 Fe2O3 + 8 SO2
- 2 ZnS + 3 O2 → 2 ZnO + 2 SO2
- PbS + O2 → Pb + SO2
- HgS + O2 → Hg + SO2
Por reacción del ácido sulfúrico con cobre elemental.[4]
- Cu (s) + 2 H2SO4 (aq) → CuSO4 (aq) + SO2 (g) + 2 H2O (l)
Reacciones
La oxidación del dióxido de azufre a trióxido de azufre en presencia de oxígeno es una reacción que ocurre en forma espontánea muy lentamente debido a su alta energía de activación.[5] Para acelerar la reacción se utilizan catalizadores como pentóxido de vanadio (V2O5) o platino que permiten la oxidación del gas a medida que se produce el contacto con el catalizador sólido.[5] Antiguamente se utilizaba como catalizador una mezcla de óxidos de nitrógeno gaseosos.[5] La oxidación mediada por catalizadores es utilizada en la fabricación industrial de ácido sulfúrico.
La oxidación del dióxido de azufre a trióxido de azufre puede producirse también por la reacción con ozono.[1] La reacción ocurre en forma espontánea en las capas altas de la atmósfera.[1] El trióxido de azufre al reaccionar con el agua presente en las nubes produce ácido sulfúrico, el cuál disminuye el pH del agua y precipita en forma de lluvia ácida.[1]
- 3 SO2 + O3 → 3 SO3
- SO3 + H2O → H2SO4
La reacción del dióxido de azufre con hidróxido de sodio produce sulfito de sodio.[6]
- SO2 + 2 NaOH → Na2SO3 + H2O
La reducción del dióxido de azufre puede producirse en presencia de reductores como el ácido sulfhídrico, obteniendose azufre elemental y agua.[6]
- SO2 (g) + 2 H2S (g) → 3 S + 2 H2O
Aplicaciones
El dióxido de azufre tiene propiedades desinfectantes, por ello fue utilizado durante siglos en la desinfección por ejemplo de las cubas de vino quemando azufre en su interior. También se utiliza en la industria alimenticia como conservante y antioxidante (E220) generalmente de zumos, frutos secos, mermeladas, vino etc.
Es un intermedio en la fabricación del ácido sulfúrico. Por reacción con cloro produce cloruro de sulfuril (SO2Cl2), un importante intermedio en la industria química. Si se hace reaccionar con el cloro y compuestos orgánicos se pueden obtener en una reacción de clorosulfonación directa, los clorosulfonatos como precursores de detergentes y otras sustancias. En estado líquido es un buen disolvente.Aspectos medioambientales
El dióxido de azufre es el principal causante de la lluvia ácida ya que en la atmósfera es transformado en ácido sulfúrico.
Es liberado en muchos procesos de combustión ya que los combustibles como el carbón, el petróleo, el diésel o el gas natural contienen ciertas cantidades de compuestos azufrados. Por estas razones se intenta eliminar estos compuestos antes de su combustión por ejemplo mediante la hidrodesulfuración en los derivados del petróleo o con lavados del gas natural haciéndolo más "dulce".
Si a pesar de estos esfuerzos aún se generan cantidades importantes del gas se pueden aplicar lavados básicos p. ej. con leche de cal para retenerlo del aire de salida o transformándolo conjuntamente con sulfhídrico en azufre elemental (proceso de Claus). También los procesos metalúrgicos liberan ciertas cantidades de este gas debido a que se emplean frecuentemente los metales en forma de sulfuros. En la naturaleza el dióxido de azufre se encuentra sobre todo en las proximidades de los volcanes y las erupciones pueden liberar cantidades importantes. Otros elementos que pueden ocasionar contaminación del aire en las ciudades lo constituyen el monóxido de carbono, el dióxido de nitrógeno, el ozono, el plomo y el sulfuro de hidrógeno.
Aspectos toxicológicos
El dióxido de azufre es un gas irritante y tóxico. Afecta sobre todo las mucosidades y los pulmones provocando ataques de tos. Si bien éste es absorbido principalmente por el sistema nasal, la exposición de altas concentraciones por cortos períodos de tiempo puede irritar el tracto respiratorio, causar bronquitis y congestionar los conductos bronquiales de los asmáticos. La concentración máxima permitida en los lugares de trabajo es de 2 ppm.
- El valor IDLH (Peligroso Para la Vida)
- Valor letal 100 ppm (262mg/m³)
- Umbral de olor 0,5 ppm (1 mg/m³) (es detectado por el olfato humano)
Referencias
- ↑ a b c d e López Arriaga, Jerónimo Amado (2003). «Contaminación atmosférica». Principios básicos de contaminación ambiental. Universidad Autónoma de México. pp. 191-216. ISBN 9688358134.
- ↑ Stanley, Manahan E. (2007). «Dióxido de azufre en la atmósfera». Introducción a la química ambiental. Reverté. pp. 411. ISBN 84-291-7907-0.
- ↑ Dickerson, Richard E. (1992). «Reacciones inorgánicas». Principios de química. Reverté. pp. 387-416. ISBN 84-291-7175-4.
- ↑ F. Burriel Martí, F. Lucena Conde, S. Arribas Jimeno, J. Hernández Méndez (2006). «Química analítica de los cationes». Química analítica cualitativa (18ª edición edición). Thomson. pp. 418-736. ISBN 84-9732-140-5.
- ↑ a b c Chemical Education Material Study, ed (1987). «Cálculos químicos». Química: una ciencia experimental. Reverté. pp. 237-245. ISBN 84-291-7120-7.
- ↑ a b Hepler, Loren G. (1965). «Hidrógeno, oxígeno y azufre». Principios de Química. Reverté. pp. 180-187.
Enlaces externos
- ATSDR en Español - ToxFAQs™: Anhídrido sulfuroso
- ATSDR en Español - Resumen de Salud Pública: Anhídrido sulfuroso
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del dióxido de azufre.
Categorías:- Óxidos de azufre
- Desinfectantes
Wikimedia foundation. 2010.

