- Pila de combustible
-
Pila de combustible
Una pila de combustible, también llamada célula o celda de combustible es un dispositivo electroquímico de conversión de energía similar a una batería, pero se diferencia de esta última en que está diseñada para permitir el reabastecimiento continuo de los reactivos consumidos; es decir, produce electricidad de una fuente externa de combustible y de oxígeno en contraposición a la capacidad limitada de almacenamiento de energía que posee una batería. Además, los electrodos en una batería reaccionan y cambian según cómo esté de cargada o descargada; en cambio, en una celda de combustible los electrodos son catalíticos y relativamente estables.
Los reactivos típicos utilizados en una celda de combustible son hidrógeno en el lado del ánodo y oxígeno en el lado del cátodo (si se trata de una celda de hidrógeno). Por otra parte las baterías convencionales consumen reactivos sólidos y, una vez que se han agotado, deben ser eliminadas o recargadas con electricidad. Generalmente, los reactivos "fluyen hacia dentro" y los productos de la reacción "fluyen hacia fuera". La operación a largo plazo virtualmente continua es factible mientras se mantengan estos flujos.
Contenido
Tecnología
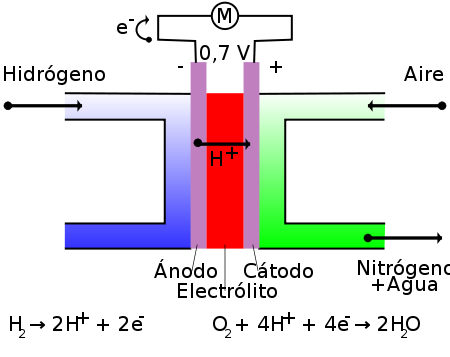
En el ejemplo típico de una célula de membrana intercambiadora de protones (o electrolito polimérico) hidrógeno/oxígeno de una celda de combustible (PEMFC, en inglés: proton exchange membrane fuel cell), una membrana polimérica conductora de protones (el electrolito), separa el lado del ánodo del lado del cátodo.
En el lado del ánodo, el hidrógeno que llega al ánodo catalizador se disocia en protones y electrones. Los protones son conducidos a través de la membrana al cátodo, pero los electrones están forzados a viajar por un circuito externo (produciendo energía) ya que la membrana está aislada eléctricamente. En el catalizador del cátodo, las moléculas del oxígeno reaccionan con los electrones (conducidos a través del circuito externo) y protones para formar el agua. En este ejemplo, el único residuo es vapor de agua o agua líquida. Es importante mencionar que para que los protones puedan atravesar la membrana, esta debe estar convenientemente humidificada dado que la conductividad protónica de las membranas poliméricas utilizadas en este tipo de pilas depende de la humedad de la membrana. Por lo tanto, es habitual humidificar los gases previamente al ingreso a la pila.
Además de hidrógeno puro, también se tiene el hidrógeno contenido en otras moléculas de combustibles incluyendo el diésel, metanol (véase DMFC) y los hidruros químicos, el residuo producido por este tipo de combustibles además de agua es dióxido de carbono, entre otros.
Tensión
La tensión de celda depende de la corriente de carga. La tensión en circuito abierto es de aproximadamente 1,2 voltios; para crear suficiente tensión, las celdas se agrupan combinándolas en serie y en paralelo, en lo que en inglés se denomina "Fuel Cell Stack" (pila de células de combustible). El número de celdas usadas es generalmente superior a 45 y varía según el diseño.
Materiales
Los materiales usados en celdas de combustible varían según el tipo. Véase Tipos de celda de combustible.
Las placas del electrodo/bipolar se hacen generalmente de nanotubos de metal, de níquel o de carbón, y están cubiertas por un catalizador (como el platino o el paladio) para conseguir una eficacia más alta. El electrolito puede ser de cerámica o bien una membrana.
Consideraciones de diseño en las celdas de combustible
- Costos. En 2002, las celdas típicas tenían un coste debido al catalizador de 850 € (aprox. 1000 USD) por kilovatio energía eléctrica útil; sin embargo, se espera que antes de 2007, sea reducida a unos 25 € (aprox. 30 USD) por kilovatio [1]. Ballard ha conseguido, gracias a un catalizador mejorado con seda de carbono (carbon silk), una reducción del 30% (1 mg/cm² a 0,7 mg/cm²) de la cantidad de platino sin una reducción en rendimiento (información de 2005)[2].
-
- Los costes MEA (del inglés Membrane Electrode Assembly, o montaje del electrodo de la membrana) del PEM (membrana intercambiadora de protones) varían según el fabricante. Así, la membrana de Nafion® de aprox. 400 €/m² utilizada en la membrana PEM de Toyota y 3M está siendo substituida por la membrana de la ITM Power, con un precio alrededor de 4 €/m² (2004). Esta membrana nueva es un hidrocarburo-polímero. Una compañía holandesa que ha realizado grandes inversiones en este terreno está utilizando Solupor® (un film de polietileno poroso)[3].
- Gestión del agua en las PEMFC. En este tipo de celdas de combustible, la membrana debe hidratarse, requiriendo evaporar el agua exactamente en la misma medida en que ésta es producida. Si el agua se evapora demasiado rápido, la membrana se seca, la resistencia a través de ella aumenta, y se agrietará, creando un "corto circuito" de gas donde el hidrógeno y el oxígeno se combinan directamente, generando calor que dañará la celda de combustible. Si el agua se evapora demasiado lentamente, los electrodos se inundarán, evitando que los reactivos puedan alcanzar el catalizador y se parará la reacción. Uno de los objetivos más importantes en la investigación sobre células de combustible es la adecuada gestión del agua.
- Gestión de la temperatura. Se debe mantener la misma temperatura en toda la celda para evitar la destrucción de la celda por fatiga térmica.
- Control de flujo. Al igual que en un motor de combustión, hay que mantener una relación constante entre el reactivo y el oxígeno para que la celda funcione eficientemente.
- Durabilidad, vida, y requisitos especiales para ciertos tipos de celdas. Los usos estacionarios requieren normalmente más de 40.000 horas operativas fiables a una temperatura de -35 °C a 40 °C, mientras que las células de combustible para automoción requieren al menos de 5.000 horas (el equivalente a unos 200.000 kilómetros) bajo temperaturas extremas. (Véase: Vehículo de hidrógeno). Las aplicaciones para automoción deben además permitir el arranque en frío hasta -30 °C y poseer una alta potencia por unidad de volumen (típicamente 2.5 kW por litro).
- Tolerancia limitada al CO (monóxido de carbono)
Tipos de celdas de combustible
Nombre Electrolito Rango Temperatura
de trabajoEficiencia
eléctricaEstado Célula de combustible reversible
Reversible fuel cellKit para la enseñanza Energía azul
Blue Energymembrana de polietileno Superior a 250 kW Investigación Célula de combustible biológica
MFC - Biological fuel cellCelda de combustible de zinc
Zinc fuel cell ('Air' fuel cell)Batería de flujo
Redox fuel cellInvestigación Pila de combustible alcalina
Alkaline fuel cell (AFC)solución alcalina de 10 a 100 kW inferior a 80°C Celda: 60–70% Sistema: 62% Comercializada/
InvestigaciónCélula de combustible de membrana de intercambio de protones
Proton exchange membrane fuel cell (PEM FC)membrana polimérica(ionomer) de 0,1 a 500 kW 70–200 °C, Celda: 50–70 % Sistema: 30–50 % Comercializada/
InvestigaciónDirect borohydride fuel cell (DBFC) solución alcalina NaOH 70 °C Investigación Formic acid fuel cell (FAFC) ácido fórmico 90–120 °C Investigación Direct methanol fuel cell (DMFC) membrana polimérica de pocos mW a 100 kw 90–120 °C Celda: 20–30 % Comercializandose/
InvestigaciónDirect-ethanol fuel cell (DEFC) Investigación Phosphoric acid fuel cell (PAFC) Ácido fosfórico Superior a 10 MW 200 °C Celda: 55 % Sistema: 40 % Comercializada/
InvestigaciónMolten carbonate fuel cell (MCFC) Carbonato-Alcalino Fundido 100 MW 650 °C Celda: 55 % Sistema: 47 % Comercializandose/
InvestigaciónProtonic ceramic fuel cell (PCFC) cerámica 700 °C Investigación Solid oxide fuel cell (SOFC) Electrolito de Óxido Cerámico Superior a 100 kW 800–1000 °C Celda: 60–65 % Sistema: 55–60 % Comercializandose/
InvestigaciónRendimiento
El rendimiento de las células de combustible, a diferencia de los motores de combustión (interna y externa) no está limitado por el ciclo de Carnot ya que no siguen un ciclo termodinámico. Por lo tanto, su rendimiento es muy alto en comparación, al convertir energía química en eléctrica directamente. El rendimiento de una celda de combustible
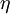 , bajo condiciones estándares está limitado por el cociente entre la variación de la energía libre (estándar) de Gibbs
, bajo condiciones estándares está limitado por el cociente entre la variación de la energía libre (estándar) de Gibbs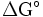 , y la variación de la entalpía estándar de la reacción química completa
, y la variación de la entalpía estándar de la reacción química completa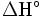 . El rendimiento real es igual o normalmente inferior a este valor.
. El rendimiento real es igual o normalmente inferior a este valor.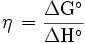
Una célula de combustible convierte normalmente la energía química de combustible en electricidad con un rendimiento aproximadamente del 50%. El rendimiento sin embargo depende en gran medida de la corriente que circula a través de la celda de combustible: cuanto mayor es la corriente, menor el rendimiento. Para una de hidrógeno, el rendimiento (energía real/energía teórica) es igual a la tensión de la celda dividida por 1,23 voltios, a una temperatura de 25 °C. Esta tensión depende del combustible usado, de la calidad y de la temperatura de la célula. Una célula que funcione a 0,6 V tendrá un rendimiento cercano al 50%, lo que significa que el 50% de la energía contenida en el hidrógeno es convertida en energía eléctrica.
Una pila de combustible y un electrolizador devuelven menos del 50 por ciento de la energía de entrada (esto se conoce como eficacia del proceso reversible), mientras que una batería de plomo y ácido mucho más barata puede devolver cerca de 90 por ciento.
Hay que considerar también las pérdidas debidas a la producción, al transporte y al almacenaje. Los vehículos con célula de combustible que funcionan con hidrógeno comprimido tienen una eficiencia del 22% si el hidrógeno se almacena como gas a alta presión, y del 17% si se almacena como hidrógeno líquido (estas cifras deberían justificar su metodología de cálculo).
Las células de combustible no pueden almacenar energía como una batería, sino que en algunos usos, como centrales eléctricas independientes basadas en fuentes "discontinuas" (solares, energía del viento), se combinan con electrolizadores y sistemas de almacenaje para formar un conjunto para almacenar esta energía. El rendimiento del proceso reversible (de electricidad al hidrógeno y de nuevo a electricidad) de tales plantas se encuentra entre el 30 y el 40%.
En "usos combinados de calor y de energía" (cogeneración), para aplicaciones donde también se requiere energía calorífica, se acepta un rendimiento más bajo de la conversión de combustible a electricidad (típicamente 15-20%), porque la mayoría de la energía no convertida en electricidad se utiliza como calor. Se pierde algo de calor con los gases que salen de la célula como ocurre en cualquier caldera convencional, por lo que con esta producción combinada de energía térmica y de energía eléctrica la eficacia sigue siendo más baja de 100%, normalmente alrededor del 80%. En términos de energía sin embargo, el proceso es ineficaz, y se obtendrían mejores resultados energéticos maximizando la electricidad generada y después usando la electricidad para hacer funcionar una bomba de calor.
Aplicaciones de las celdas de combustible
Las celdas de combustible son muy útiles como fuentes de energía en lugares remotos, como por ejemplo naves espaciales, estaciones meteorológicas alejadas, parques grandes, localizaciones rurales, y en ciertos usos militares. Un sistema con celda de combustible que funciona con hidrógeno puede ser compacto, ligero y no tiene piezas móviles importantes.
Aplicaciones de cogeneración (uso combinado de calor y electricidad) para viviendas, edificios de oficinas y fábricas. Este tipo de sistema genera energía eléctrica de manera constante (vendiendo el exceso de energía a la red cuando no se consume), y al mismo tiempo produce aire y agua caliente gracias al calor que desprende. Las celdas de combustible de Ácido fosfórico (PAFC Phosphoric-Acid Fuel Cells) abarcan el segmento más grande de aplicaciones de cogeneración en todo el mundo y pueden proporcionar eficacias combinadas cercanas al 80% (45-50% eléctrico + el resto como térmica). El mayor fabricante de células de combustible de PAFC es UTC Power, una división de United Technologies Corporation. También se utilizan celdas de combustible de carbonato Fundido (MCFC Molten Carbonate Fuel Cell) con fines idénticos, y existen prototipos de celdas de óxido sólido (SOFC Solid-Oxide Fuel Cell).
Los sistemas electrolizadores no almacenan el combustible en sí mismos, por lo que necesitan de unidades de batería externas, lo que supone un problema serio para áreas rurales. En este caso, las baterías tienen que ser de gran tamaño para satisfacer la demanda del almacenaje, pero aun así esto supone un ahorro con respecto a los dispositivos eléctricos convencionales.
Existe un programa experimental en Stuart Island en el estado de Washington, donde la compañía Stuart Island Energy Initiative ha construido un sistema completo en el cual los paneles solares generan la corriente para hacer funcionar varios electrolizadores que producen hidrógeno. Dicho hidrógeno se almacena en un tanque de 1900 litros, a una presión de 10 a 80 bar. Este combustible finalmente se utiliza para hacer funcionar una celda de combustible de hidrógeno de 48 V ReliOn que proporciona suficiente energía eléctrica para fines residenciales en la isla (véase el enlace externo a SIEI.ORG).
Protium, una banda de rock formada en la Ponaganset High School, en Glocester, fue el primer conjunto musical del mundo en utilizar celdas de combustible de hidrógeno para proveerse de energía. La banda utilizaba un Airgen Fuelcell de 1kw Ballard Power systems. El conjunto ha tocado en numerosos eventos relacionados con las celdas de combustible incluyendo el CEP de Connecticut, y el 2003 Fuel Cell Seminar en Miami beach.
Plug Power Inc. es otra compañía importante en el diseño, desarrollo y fabricación de celdas de combustible PEM para aplicaciones estacionarias, incluyendo productos dirigidos a las telecomunicaciones, energía básica, y aplicaciones de cogeneración.
Otros posibles usos
- Plantas de potencia
- Vehículos Eléctricos
- Sistemas Auxiliares de Energía
- Sistemas de apoyo a la red eléctrica
En la actualidad, los mayores problemas residen en los materiales de soporte y de catálisis. Según diversos autores(Venkatachalapathy, Davila et al. 1999), (Hoogers 2003), un material electrocatalizador debe satisfacer varios requisitos. Necesita, en primer lugar, alta eficiencia en la oxidación electroquímica del combustible en el ánodo, (e.g. H2 o CH4) y para la reducción del O2 en el cátodo. Una elevada durabilidad es también un requisito fundamental: se espera que las PEMFCs funcionen al menos durante 10.000 horas. Es necesario que un electrocatalizador tenga una buena conductividad eléctrica para reducir al mínimo las pérdidas por resistencia en la capa del catalizador. Ha de tener finalmente un bajo coste de producción.
Vehículos de hidrógeno, barcos, aviones y estaciones de servicio
La primera estación de reabastecimiento de hidrógeno como combustible fue abierta en Reykjavík, Islandia en abril de 2003. Esta estación abastece a tres autobuses construidos por DaimlerChrysler y que prestan servicio en la red de transporte público de Reykjavík. La propia estación produce el hidrógeno que necesita, gracias a una unidad electrolizadora (fabricada por Norsk Hydro), y no necesita ser abastecida externamente: los únicos suministros necesarios son electricidad y agua. Shell también participa en el proyecto. La estación no tiene cubierta, para que en caso de peligro el hidrógeno pueda escapar libremente a la atmósfera.
Hay numerosos prototipos y modelos de coches y autobuses basados en la tecnología de la pila de combustible. Las empresas de automoción siguen investigando y ya han llegado a fabricar algunos prototipos. Compañías como DaimlerChrysler, Ballard Power Systems, Ford, Volvo, Mazda, General Motors, Honda, BMW, Hyundai, o Nissan, entre otras. Según la industria del automóvil se espera que los primeros vehículos comerciales estén disponibles en el 2010.
Los submarinos Type 212A, un avanzado diseño alemán no nucleares, utiliza pilas de combustible (desarrolladas por Siemens) para alimentar nueve propulsores y puede mantenerse sumergido durante semanas sin tener que subir a la superficie.
En abril de 2008, en Toledo (España), la compañía Boeing hizo volar el primer avión propulsado por pila de hidrógeno.[1] De manera parecida Airbus está desarrollando un prototipo de avión que utiliza esta tecnología.
Actualmente, un equipo de estudiantes universitarios llamado Energy-Quest está preparando un barco accionado por esta tecnología para hacer un viaje alrededor del mundo, así como otros proyectos usando combustibles más eficientes o renovables. Su empresa se llama Tritón.
Economía y Medio Ambiente
Las celdas de combustible son muy atractivas para usos avanzados por su alta eficacia e idealmente (véase energías renovables) por ser de emisiones cero, en contraste con los combustibles actuales más comunes, como puedan ser el metano o el gas natural, que siempre generan dióxido de carbono. Casi el 50% de toda la electricidad que es producida en los Estados Unidos, es procedente del carbón, que es una fuente de energía relativamente sucia. Si se utiliza electrólisis para crear el hidrógeno usando la energía procedente de las centrales eléctricas, en realidad el hidrógeno es creado a partir de carbón. Aunque la celda de combustible sólo emita calor y agua como residuos, el problema de la contaminación continuará presente en las centrales eléctricas.
Un acercamiento global debe considerar los impactos provocados por el escenario completo del hidrógeno, lo que incluye la producción, el uso, la infraestructura y los conversores de energía. Las pilas de combustible hoy en día están sobredimensionadas de catalizador, para compensar su propio deterioro [4]. La limitación en las reservas minerales de platino ha provocado la búsqueda de otras soluciones, por ejemplo la síntesis de un complejo inorgánico muy similar a la base catalítica del hierro-sulfuro de las bacterias hidrogenasas [5]. Las reservas mundiales de platino serían insuficientes (una cuarta parte) del necesario para permitir una conversión total de los vehículos a células de combustible: una introducción significativa de vehículos con la actual tecnología, por lo tanto, provocaría un gran incremento del precio del platino y un descenso significativo de sus reservas.
Historia
El principio de funcionamiento de la célula de combustible fue descubierto por el científico Christian Friedrich Schönbein en Suiza en 1838 y publicado en la edición de enero de 1839 del "Philosophical Magazine". De acuerdo con este trabajo, la primera fue desarrollada en 1843 por Sir William Grove, un científico galés, utilizando materiales similares a los usados hoy en día para la célula de ácido fosfórico. No fue hasta 1959 cuando el ingeniero británico Francis Thomas Bacon desarrolló con éxito una célula estacionaria de combustible de 5 kilovatios.
En 1959, un equipo encabezado por Harry Ihrig construyó un tractor basado en una célula de combustible de 15 kilovatios para Allis-Chalmers que fue expuesto en EE.UU. en las ferias del estado. Este sistema utilizó hidróxido de potasio como electrolito e hidrógeno y oxígeno comprimidos como reactivos.
Más adelante, en 1959, Bacon y sus colegas fabricaron una unidad de 5 kW capaz de accionar una máquina de soldadura, que condujo, en los años 60 a que las patentes de Bacon licenciadas por Pratt y Whitney en los Estados Unidos (al menos la idea original) fuesen utilizadas en el programa espacial de Estados Unidos para proveer a los astronautas de electricidad y de agua potable a partir del hidrógeno y oxígeno disponibles en los tanques de la nave espacial.
Paralelamente a Pratt & Whitney Aircraft, General Electric desarrolló la primera pila de membrana de intercambio de protones (PEMFCs) para las misiones espaciales Gemini de la NASA. La primera misión que utilizó PEFCs fue la Gemini V. Sin embargo, las misiones del Programa Apolo y las misiones subsecuentes Apolo-Soyuz, del Skylab, y del transbordador utilizaban celdas de combustible basadas en el diseño de Bacon, desarrollado por Pratt & Whitney Aircraft.
UTX, subsidiara de UTC Power fue la primera compañía en fabricar y comercializar un sistema de células de combustible estacionario a gran escala, para su uso como central eléctrica de cogeneración en hospitales, universidades, y grandes edificios de oficinas. UTC Power continúa comercializándola bajo el nombre de PureCell 200, un sistema de 200 kilovatios, y sigue siendo el único proveedor para la NASA para su uso en vehículos espaciales, proveyendo actualmente al trasbordador espacial. Además está desarrollando celdas de combustible para automóviles, autobuses, y antenas de telefonía móvil. En el mercado de automoción, UTC Power fabricó la primera capaz de arrancar a bajas temperaturas: la célula de membrana de intercambio de protones (PEM).
Los materiales utilizados eran extremadamente caros y las celdas de combustible requerían hidrógeno y oxígeno muy puros. Las primeras celdas de combustible solían requerir temperaturas muy elevadas que eran un problema en muchos usos. Sin embargo, se siguió investigando en celdas de combustible debido a las grandes cantidades de combustible disponibles (hidrógeno y oxígeno).
A pesar de su éxito en programas espaciales, estos sistemas se limitaron a aplicaciones especiales, donde el coste no es un problema. No fue hasta el final de los años 80 y principios de los 90 que las celdas de combustible se convirtieron en una opción real para uso más amplio. Varias innovaciones, catalizador con menos platino y electrodos de película fina bajaron su coste, haciendo que el desarrollo de sistemas PEMFC (para, por ejemplo, automóviles) comenzara a ser realista.
Gerhard Ertl, ganador del Premio Nobel de Química en 2007, fue el descubridor del funcionamiento de las pilas de combustible.
Bibliografía
- Gregor Hoogers, Hoogers Hoogers - Fuel Cell Technology Handbook - Edita:CRC Press Enero de 2003 - ISBN 0-8493-0877-1
- Venkatachalapathy, R., G. P. Davila, et al. (1999). "Catalytic decomposition of hydrogen peroxide in alkaline solutions." Electrochemistry Communications 1: 614-617.
Referencias
- ↑ «Boeing presenta el primer avión de pila de hidrógeno». Consultado el 15 de enero de 2009.
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre Pila de combustible.Commons
Wikimedia Commons alberga contenido multimedia sobre Pila de combustible.Commons- Explícame: Celdas de energía
- Celdas de Combustible
- Ballard Power Systems
- Hydrogen Fuel Cell Realm
- EERE: Fuel Cell Types
- EERE: Hydrogen, Programa de Infraestructuras y Celdas de combustible del gobierno de EEUU
- How Stuff Works: Celdas de Combustible
- La celda de combustible
- Hydrogen Trade: Tipos de celdas de Combustible
- PhysicsWorld: Celdas de combustible
- FuelCell Energy Inc.
- UTC Power, una subsidiaria de United Technologies Corporation
- Plug Power Fuel Cell Systems
- Electrocell - Celda de Combustible, Stacks, Equipamiento de Testes
- Vehículos impulsados por hidrógeno
- Componentes para pilas
- Stuart Island Energy Initiative (en inglés)
- Pilas de combustible basadas en Goretex para vehículos híbridos
Véase también
- hidrógeno
- economía del hidrógeno
- metanol (combustible)
- metanol
- etanol (combustible)
- etanol
- Biocombustible
Categorías: Energías renovables | Inventos galeses | Electroquímica | Pila de combustible
Wikimedia foundation. 2010.