- Linfocito T
-
Los linfocitos T o células T pertenecen al grupo de leucocitos que son conocidos como linfocitos. Estas células tienen núcleos de forma ovoide que ocupan la mayoría del espacio intracelular.
Los linfocitos T son los responsables de coordinar la respuesta inmune celular constituyendo el 70% del total de los linfocitos que segregan proteínas o citoquinas. También se ocupan de realizar la cooperación para desarrollar todas las formas de respuestas inmunes, como la producción de anticuerpos por los linfocitos B.
Se diferencian de los linfocitos B y de las células asesinas (natural killer o NK) por poseer un receptor especial en la superficie de la membrana, el Receptor de linfocitos T (denominado TCR por T cell receptor). Sin embargo, en un frotis microscópico de sangre no es posible distinguir uno de otro a simple vista.
La denominación de estos linfocitos como "T" se debe a que su maduración tiene lugar en el timo (órgano linfoide que constituye uno de los controles centrales del sistema inmunitario del organismo). El número de leucocitos en sangre periférica en un humano promedio es de 4 a 11 x 10 9 por litro, del cual, normalmente, un 20% son linfocitos.
Los linfocitos T de un individuo concreto presentan una propiedad denominada restricción CMH: sólo pueden detectar un antígeno si éste viene presentado por una molécula del complejo mayor de histocompatibilidad (CMH) del mismo individuo. Esto se debe a que cada linfocito T tiene una especificidad dual: el receptor del linfocito T (TCR) reconoce algunos residuos del péptido y simultáneamente algunos residuos de la molécula CMH que lo presenta. Esta propiedad es muy importante en el trasplante de órganos, e implica que, durante su desarrollo, los linfocitos T deben "aprender" a reconocer las moléculas CMH propias del individuo, un proceso complejo que tiene lugar en el timo. Puesto que las moléculas CMH sólo pueden presentar péptidos, esto implica que los linfocitos T, dado que sólo pueden reconocer un antígeno si viene asociado a una molécula CMH, sólo pueden reaccionar ante antígenos de origen proteico (procedentes de microbios) y no a otro tipo de compuestos químicos (ni lípidos, ni ácidos nucleicos, ni azúcares). Las moléculas CMH adquieren el péptido que presentan en el exterior de la membrana celular durante su propia biosíntesis, en el interior celular. Por tanto, los péptidos que presentan las moléculas CMH provienen de microbios que están en el interior celular, y ésta es la razón por la cual los linfocitos T sólo detectan microbios asociados a células y desencadenan una respuesta inmune contra microbios intracelulares.[1]
Contenido
Tipos
Se han descrito varios subtipos de células T, cada uno de ellos con una función distintiva.[1]
- Linfocitos T citotóxicos (CTL, por sus siglas en inglés) o linfocitos CD8+ encargados de las funciones efectoras de la inmunidad celular, mediante la interacción con un complejo "péptido-CMH-I"; los CTL reconocen las células infectadas por el patógeno parao células tumorales, y las destruyen segregando una serie de moléculas (perforina, granzimas, FasL) que activan la apoptosis de la célula diana.
- Linfocitos T cooperadores o linfocitos CD4+ o helper T cells: se encargan de iniciar la cascada de la respuesta inmune coordinada mediante la interacción con un complejo "péptido-CMH-II". Cuando se activan, los linfocitos CD4+ se especializan, diferenciándose a su vez en linfocitos efectores, que se distinguen por el tipo de citoquinas que producen:
-
- Th1, que migran a los tejidos infectados y colaboran en la activación de los macrófagos, ya que los Th1 segregan fundamentalmente interferón γ; los Th1 son importantes en la defensa frente a los microbios intracelulares y la inflamación;
- Th2, que permanecen sobre todo en los tejidos linfoides y colaboran en la activación de los linfocitos B; segregan principalmente IL-4 (que estimula la secreción de Ig-E, que a su vez activa los mastocitos) e IL-5 (que activa los eosinófilos); los Th2 son importantes en las reacciones alérgicas y en la defensa frente a parásitos;
- Th17, denominados así porque segregan IL-17, además de IL-22; son los principales mediadores en algunas reacciones alérgicas, y parecen estar implicados en el desarrollo de enfermedades como la esclerosis múltiple, la artritis reumatoide y la enfermedad inflamatoria intestinal.
- La diferenciación en Th1, Th2 o Th17 no es al azar, sino que depende de los estímulos que reciba el linfocito T4 virgen cuando contacte un antígeno extraño.
- Linfocitos T de memoria: son células que se generan después de la activación de los linfocitos T, por exposición a un antígeno extraño (un patógeno). Tienen vida larga, son funcionalmente inactivos, y pueden circular durante meses o años, preparados para responder a nuevas exposiciones al mismo microbio. El objetivo de las vacunas es precisamente generar linfocitos de memoria (T y B) mediante la exposición a un patógeno atenuado, de manera que el organismo responda de manera rápida y eficaz frente al patógeno activo.
- Linfocitos T reguladores (células Treg), anteriormente conocidos como células T supresoras. Su función principal es eliminar la inmunidad mediada por células al final de la reacción inmune y eliminar células T auto-reactivas que escaparon al proceso de selección negativa en el timo.
- Células T natural killers (NK). Son un tipo especial de linfocitos, situados entre la respuesta inmune adaptativa (mediada por linfocitos), y la respuesta inmune innata (la inflamación). Las células NK provienen del mismo precursor hematopoyético que el resto de los linfocitos T, pero no expresan el TCR. Sin embargo, estas células pueden recibir dos tipos de señales:
-
- activadoras:
- - las células NK expresan las moléculas Fas-L o TRAIL, capaces de detectar la presencia de Fas o TRAIL-R en la célula diana, relacionadas con la apoptosis;
- - la ausencia de moléculas CMH-I en la superficie de la célula diana, bien por infección viral o desarrollo tumoral (que ha bloqueado la producción de moléculas CMH-I), bien porque se trata de una célula exógena, en el caso de un transplante
- inhibidoras: mediada por los receptores específicos para las moléculas CMH-I, denominados KIR, por killer-cells immunoglobulin receptor. Estos receptores pertenecen a una familia de multigenes similares a las inmunoglobulinas, que han evolucionado recientemente; son los receptores principales tanto para moléculas CMH-I clásicas (HLA-A, HLA-B, HLA-C) y para la molécula CMH-I no clásica HLA-G en primates. Algunos KIR son específicos para ciertos subtipos HLA.
- Durante su desarrollo, es necesario que la célula NK reconozca con sus receptores inhibidores el CMH-I para convertirse en célula asesina. La expresión de los receptores inhibidores es al azar, de manera que se expresan en ausencia de ligando. Además, las células NK son "anérgicas": no son funcionales, en ausencia de activación. Una vez activadas, estas células pueden realizar funciones relacionadas tanto con los linfocitos T4 (cooperadores) como con los T8 (citotóxicos): producción de citoquinas y liberación de moléculas citolíticas, capaces de destruir la célula objetivo. Las células NK, por tanto, van a destruir todas aquellas células que carezcan de moléculas CMH-I, ya que éstas son células que se identifican como potencialmente dañinas: infectadas o tumorales. En el caso de las células transplantadas (exógenas), es una situación no fisiológica, y la activación de las células NK constituye una de las principales barreras al transplante. En general, la tolerancia de las células NK hacia las células propias está asegurada porque un único receptor CMH-I activado es suficiente para asegurar la inhibición, ya que la señalización inhibidora es dominante frente a la activadora.
- Células T gamma/delta. Son un pequeño grupo de células T que poseen un TCR específico en su superficie. La mayor parte de los linfocitos tienen un TCR compuesto por dos cadenas glucoproteicas denominadas α y β. Sin embargo, en las células γδ, el TCR está formado por una cadena γ y una cadena δ. Este grupo de linfocitos es muy poco frecuente (5% del total), pero son abundantes en la mucosa del intestino, formando parte de una población de linfocitos denominada linfocitos intraepiteliales. Los antígenos que activan estos linfocitos eran desconocidos, se ha descubierto una presentación de glucoproteinas como antigenos, en vez de péptidos. Sin embargo, los linfocitos γδ no presentan restricción CMH, y parece que reconocen proteínas completas en lugar de péptidos, aunque algunos reconocen moléculas CMH-IB.
Maduración y selección de las células T
Como pasa con todas las células linfocíticas, las células T provienen de una célula progenitora hematopoyética. Las células progenitoras de los linfocitos T migran desde la médula ósea hacia el timo, donde tiene lugar todo el proceso de maduración, generando células que expresan TCR y CD4 o CD8. Varias etapas definen esa diferenciación:[1]
Reorganización de los genes TCR
- Pro-T. La célula pro-T es el primer precursor de la línea de linfocitos T. Estas células proliferan por efecto de la interleuquina IL-7 producida por las células del timo. En el núcleo de algunas de estas células, se reordenan los genes que codifican la cadena β del TCR, por recombinación mediada por la V(D)J recombinasa. El TCR no se expresa aún en la superficie del pro-T. Tampoco se expresan en la membrana celular las moléculas accesorias CD4 ni CD8. Por esa razón las células pro-T se denominan CD4-/CD8- o dobles negativas.
- - El reordenamiento de la cadena β ocurre al activarse uno de los dos alelos que codifican la cadena β. El otro alelo es inhibido durante el reordenamiento del alelo activado (esto se denomina "exclusión alélica"). Si no se produce una cadena β completa en una célula pro-T, esa célula muere.
- Pre-T. Si la recombinación VDJ tiene lugar con éxito y se sintetiza una cadena β, ésta se expresa en la superficie celular, unida a una proteína invariante denominada pre-Tα, para formar el complejo pre-TCR. Por tanto, la célula pre-T es la misma célula pro-T a partir del momento en que la cadena β del TCR se expresa en la superficie celular. La expresión de la cadena β marca el estadio pre-T y al mismo tiempo comienza el reordenamiento de la cadena α. En las pre-T, aún siguen sin expresarse en la membrana celular las moléculas accesorias CD4 ni CD8, así que las células pre-T son CD4-/CD8- o dobles negativas.
- - La expresión en microdominios de la membrana celular de la cadena β unida a la proteína pre-Tα se conoce como pre-TCR y estimula el reordenamiento de uno de los alelos que codifican la cadena α. Si una célula no es capaz de sintetizar una cadena α y el TCR completo, esa célula muere.
- Timocito doble-positivo. Estas son las células supervivientes, que expresan tanto la cadena α como β, es decir un TCR completo, CD3 y tanto CD4 como CD8. Por ello se denominan dobles positivas. Ello da paso a los mecanismos de selección positiva y negativa.
Selección positiva de los timocitos
En esta fase tiene lugar la puesta en marcha del mecanismo de restricción CMH: los linfocitos T de un individuo concreto sólo pueden detectar un antígeno si éste viene presentado por una molécula del complejo mayor de histocompatibilidad (CMH) del mismo individuo. Los diferentes clones de timocitos dobles negativos expresan diferentes tipos de TCR αβ. Si el TCR de una célula T reconoce una molécula CMH en el timo (que por definición es una molécula CMH presentando un péptido propio del individuo), esa célula T es seleccionada para sobrevivir: por eso se habla de selección positiva. Para asegurarse de que el linfocito T durante su maduración será expuesto a todo tipo de péptido propio, las células epiteliales medulares del timo expresan numerosos genes, que codifican la mayor parte de las proteínas presentes en los tejidos periféricos.
Las células que no son capaces de reconocer un complejo "péptido propio-CMH" en el timo mueren por apoptosis. Estas células no serían útiles al individuo, porque serían incapaces de ver los péptidos presentados por las moléculas de CMH en los tejidos periféricos.
Elección entre las líneas T CD4+ y CD8+
Durante el proceso de selección positiva, las células T que reconocen complejos péptido-CMH clase-I preservan la expresión de CD8, el coreceptor que se une a la molécula CMH-I, y pierden la expresión de las moléculas de CD4. A la inversa, las células que reconocen complejos péptido-CMH clase-II preservan la expresión de CD4 y pierden la de CD8.
Así, lo que se obtiene al final del proceso de selección positiva son timocitos simples positivos, que son o bien CD8+, restringidos para ver CMH-I, o bien CD4+, restringidos para CMH-II.
Además, durante este proceso, las células T también devienen segregadas funcionalmente: las células T CD8+ pueden convertirse en linfocitos T citotóxicos cuando se activan, mientras que las células T CD4+ serán linfocitos T cooperadores. Se desconoce cómo la selección de co-receptores está asociada a la segregación funcional.
Selección negativa de los linfocitos
Los linfocitos dobles positivos inmaduros cuyos receptores reconocen fuertemente los complejos "péptido:CMH" en el timo también sufren apoptosis. Este es el proceso de selección negativa, que sirve para eliminar linfocitos que podrían reaccionar de forma dañina contra proteínas propias que se expresan en el timo. Por ello, se dice que este mecanismo permite el establecimiento de la tolerancia central, al asegurar que las proteínas propias no serán atacadas por los linfocitos T.
Las células T que han pasado los procesos de selección positiva y negativa son linfocitos maduros, que presentan las siguientes características:
- son simples positivos CD4+ o CD8+;
- están restringidos para las moléculas CMH propias (CD4+:CMH-II, CD8+:CMH-I);
- son tolerantes para las proteínas propias;
- son vírgenes (naïves): no han encontrado nunca un antígeno extraño.
Los linfocitos maduros salen del timo y se distribuyen por la periferia a través del sistema circulatorio, donde pueden encontrar una célula que presente un complejo "péptido extraño:CMH", capaz de activar el linfocito y desecadenar una respuesta inmune.
Es interesante destacar que la capacidad de reconocer los antígenos extraños por parte de los linfocitos T no está sometida a selección, sino que es el producto del azar: las células T que reconocen los complejos "péptido propio:CMH propio" de forma débil puede que reconozcan fuertemente antígenos extraños, procedentes de microbios, en la periferia del organismo.
Activación de linfocitos T
La activación de linfocitos T tiene dos consecuencias generales:
- En el ganglio linfático, la activación de los linfocitos T conduce a la activación de células efectoras inmunes.
- En los téjidos periféricos, la activación de linfocitos T conduce a la erradicación del microorganismo del foco infeccioso
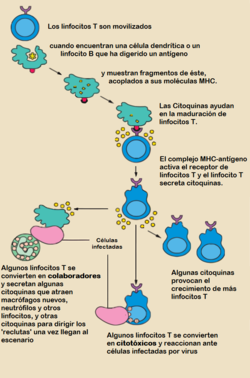
Una de las primeras respuestas detectables de los linfocitos T a la presentación y reconocimiento antigénico por células presentadoras de antígeno (CPA) es la secreción de citocinas, en especial la Interleucina-2 (IL-2), la cual actúa como factor de crecimiento sobre el mismo linfocito T que lo secreta, por tener ésta receptores para la IL-2. Bajo el efecto de la IL-2, la célula T sufre una proliferación numérica exponencial, denominada expansión clonal, la cual es el fundamento de la memoria inmunitaria. La expansión clonal es seguida por una diferenciación celular, produciendo linfocitos CD4 -encargados de la activación de macrófagos, linfocitos B y otras células- y linfocitos CD8 -las cuales eliminan ciertas «células diana» infectadas y también activan macrófagos en los tejidos afectados.
Receptor de la IL-2
La Interleucina-2 es producida por el cuerpo durante una respuesta inmune,[2] [3] cuando un antígeno (sea una molécula o un microbio) es reconocido por receptores antigénicos sobre CPA (usualmente una célula dendrítica). La presentación y unión de un pequeño segmento del antígeno, por el HMC, a una célula T por intermedio de su receptor (TCR) estimula la secreción de IL-2 y al mismo tiempo, la expresión de receptores de IL-2 (IL-2R). La subsecuente interacción de IL-2 con IL-2R, estimula el crecimiento, diferenciación y supervivencia de las seleccionadas —por el tipo de antígeno— células citotóxicas, por medio de la activación de genes específicos.[4] [5] [6] Esto asegura que solo la célula T con el receptor específico al péptido antigénico sea la activada.
Una vez que IL-2 se une a los dominios externos de su receptor, IL-2R, y los dominios internos son activados, la señal de activación continúa hasta que el complejo IL-2/IL-2R es internalizada y degradada. Sin embargo, cada célula tomará el irrevocable cometido de replicar su ADN y pasar por la mitosis y citocinesis solamente cuando un número crítico de IL-2R han sido expresados y activados.[7]
CD28 y B7
La activación de las células T ocurre a través de la interacción, tanto del receptor de la célula T (TCR) y de la molécula CD28 con el complejo mayor de histocompatibilidad (MHC) y la familia de receptores B7 sobre la CPA, respectivamente. Se requieren ambas interacciones para la producción de una respuesta inmune eficaz. En la ausencia de la co-estimulación del CD28, las señalizaciones dirigidas por el TCR reultará en anergia. Desde este punto de activación, las vías de señalización del linfocito T, ocupan muchas proteínas.
IL-12, IL-4
Las moléculas Interleucina-12 e Interleucina-4 juegan un papel importante en la diferenciación de linfocitos T. IL-12 está involucrada en la diferenciación de células CD4+ en células TH1, lo cual es importante en la activación de macrófagos (por medio del interferón gamma) y la destrucción de patógenos. A su vez, IL-4 participa en la diferenciación de linfocitos T en subpoblaciones células TH2.
CD40 y CD40L
La molécula del CD40 es una proteína co-estimuladora presente en CPA (un linfocito B, por ejemplo), el cual se une a su ligando, CD40L (CD154) sobre los linfocitos T, activando a la célula, en especial CD4+. Esta interacción CD40:CD40L, a su vez potencia la capacidad de moléculas co-estimuladoras sobre las CPA para actuar en la diferenciación de células T.
Enlaces externos
Referencias
- ↑ a b c Abbas, A.B.; Lichtman A.H.. «Ch.4 Antigen recognition in the adaptive inmune system». Basic Immunology. Functions and disorders of the immune system (3rd edición). Saunders (Elsevier). ISBN 978-1-4160-4688-2.
- ↑ Cantrell, D.A. & Smith, K.A. (1984) Science 224: 1312
- ↑ Smith, K.A. (1988) Science 240: 1169
- ↑ Stern, J. & Smith, K.A. (1986) Science 233:203
- ↑ Beadling, C. et al. (1993) Proc. Nat. Acad. Sci. U.S.A. 90:2719
- ↑ Beadling, C.B. & Smith, K.A. (2002) Med. Immunol. 1:2
- ↑ Cantrell, DA and Smith, KA (1984) Science 224:1312
Categoría:- Linfocitos
Wikimedia foundation. 2010.