- Citocromo P450
-
El citocromo P450 (abreviado CYP en inglés, o CIP en español, o simplemente P450) es una enorme y diversa superfamilia de hemoproteínas encontradas en bacterias, archaea y eucariotas.[1] Las proteínas del citocromo P450 usan un amplio rango de compuestos exógenos y endógenos como sustratos de sus reacciones enzimáticas. Por lo general forman parte de cadenas de transferencia de electrones con multicomponentes, denominadas sistemas contenedoras de P450. La reacción más común catalizada por el citocromo P450 es una reacción monooxigenasa, es decir, la inserción de un átomo de oxígeno molecular (O2) en un sustrato orgánico (RH) a la vez que el otro átomo de oxígeno es reducido a agua:
RH + O2 + 2H+ + 2e– → ROH + H2O
Contenido
Historia
Se identificó en 1958 como un pigmento celular reducido y unido a membrana con un pico de absorción inusual a los 450 nm.[2] [3] Posteriormente, en 1964, se sugiere el nombre de Citocromo P450 por Omura y Sato, nombre por el que se conoce actualmente.[4] [5]
Distribución
Las enzimas CIP han sido identificadas en todas los linajes de vida orgánica, incluyendo los mamíferos, aves, peces, insectos, gusanos, plantas, hongos, etc. Se conocen más de 7.700 secuencias de CYP (para septiembre de 2007).
Etimología
El nombre citocromo P450 proviene del hecho que éstas son proteínas celulares (cito) coloreadas (cromo), con un pigmento que absorbe luz a una longitud de onda de 450 nanómetros, justo donde el hierro del grupo hemo es reducido y forma complejos con el monóxido de carbono.
Nomenclatura
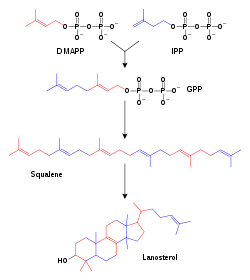
Los genes que codifican a las enzimas CIP, y las enzimas mismas, se designan con la abreviación CYP o CIP, seguida de un numeral que indica la familia del gen, luego una letra mayúscula que indica la subfamilia y otro número para el gen individual. Por convención se escribe el nombre en cursiva cuando la abreviación se refiere al gen. Por ejemplo, el CYP2E1 es el gen que codifica a la enzima CYP2E1—una de las enzimas asociadas con el metabolismo del paracetamol (acetaminofén). A pesar de que ésta es la nomenclatura preferida en la literatura, existen ciertas variaciones para algunos genes o enzimas que hace hincapié en la actividad catalítica y el nombre del compuesto que usa como sustrato. Algunos ejemplos incluyen al CYP5, tromboxano A2 sintasa, abreviado TXAS (TromboXano A2 Sintasa), y CYP51, lanosterol 14-α-demetilasa, abreviada LDM por razón de su sustato (Lanosterol) y su actividad (DeMetilación).[6]
Las normativas de la nomenclatura actual sugiere que los miembros de las nuevas familias de CYP comparten más del 40% de su identidad en aminoácidos, mientras que los miembros de las subfamilias comparten más del 55% de identidad en aminoácidos. Un comité de nomenclatura es el organismo encargado de hacer seguimiento y asignar nuevos nombres.
CYP en el hombre
Los CYP en el hombre son proteínas asociadas a las membranas citoplasmática, mitocondrial y del retículo endoplásmico, donde actúan metabolizando cientos de sustancias endógenas y exógenas.
La mayoría de los CYP actúan sobre varios sustratos, pudiendo algunas de ellas catalizar varios tipos de reacciones. In vivo, estos sustratos incluyen numerosas drogas o componentes tóxicos derivados de metabolismo, como es el caso de la bilirrubina. Las enzimas del citocromo p450 están presentes en la mayoría de los tejidos del organismo, jugando un papel fundamental en la síntesis de hormonas (incluyendo estrógenos y testosterona), colesterol o vitamina D3, aún cuando son las CYP del hígado las más estudiadas.
Por otra parte, el CYP constituye el mayor complejo enzimático involucrado en el metabolismo de los fármacos en nuestro organismo, al jugar un papel fundamental en la fase oxidativa del metabolismo (conocida como fase I). Algunos de estos fármacos tienen la capacidad de aumentar o disminuir la actividad de las enzimas (fenómenos conocidos como inducción enzimática e inhibición enzimática, respectivamente). Esto tiene una trascendencia fundamental en la valoración de las interacciones de fármacos entre sí. Si, por ejemplo, un fármaco inhibe la enzima que degrada a un segundo fármaco, en presencia de ambos el segundo fármaco aumentará sus niveles en sangre y, subsiguientemente, las posibilidades de dar patología por sobredosis. De forma inversa, si lo que hace es inducir el metabolismo, las concentraciones del segundo fármaco disminuirán, estando por debajo de los niveles terapéuticos, factor de vital importancia por ejemplo en los antibióticos. Esto nos lleva a que sea necesario un completo conocimiento de las enzimas implicadas en el metabolismo de los fármacos utilizados en el hombre para evitar errores de ventana terapéutica o de efectos secundarios. Especialmente los laboratorios farmacéuticos están muy interesados en estos estudios por las posibilidades que presentan.
No sólo los fármacos son objeto de estudio en relación con las interacciones. Así mismo, se están investigando efectos similares con sustancias naturales. Por ejemplo, se ha descubierto que los zumos de algunos frutos, como el zumo de pomelo, tienen capacidad de inhibir la actividad de la CYP3A4, enzima implicada en el metabolismo de algunos fármacos, actividad que realizan a través de sustancias como la bergamotina, la dihidroxi-bergamotina o la paradisina A. Otras interacciones de interés pueden ser las de algunas plantas (Hypericum perforatum), inductora de CYP3A4 o el humo del tabaco, inductor de CYP1A2.
Para hacernos una idea más cercana de la trascendencia del tema referido, podemos ver a continuación una relación de los fármacos más importantes que pueden ver alterada su eficacia si se toma de forma concomitante zumo de pomelo:
- Benzodiazepinas como el triazolam o alprazolam.
- Ritonavir.
- Estatinas como la atorvastatina, lovastatina y simvastatina.
- Dihidropiridinas incluyendo el felodipino, nicardipino, difedipino, nisoldipino o el nitrendipino.
- Losartán.
- Repaglinida.
- Verapamil.
- Antiarrítmicos incluyendo amiodarona, quinidina, disopiramina, propafenona y carvedilol.
- Fármacos para la impotencia como el sildenafil, tadalafil y vardenafil.
- Los antimigrañosos como la ergotamina y nimodipino.
- Fluvoxamina.
- Codeína y Tramadol.
- Ciclosporina.
Familias del CYP humano.
El ser humano tiene 57 genes y más de 59 pseudogenes agrupados en 18 familias y 43 subfamilias.[7] La siguiente tabla muestra un resumen de los genes y de las proteínas que codifican. Para información más detallada, acceder a la página del Comité de Nomenclatura del Citocromo P450.[8]
Familia Función Miembros Nombres. CYP1 Metabolismo de drogas y esteroides (especialmente estrógenos) 3 subfamilias, 3 genes, 1 pseudogen CYP1A1, CYP1A2, CYP1B1 CYP2 Metabolismo de drogas y esteroides 13 subfamilias, 16 genes, 16 pseudogenes CYP2A6, CYP2A7, CYP2A13, CYP2B6, CYP2C8, CYP2C9, CYP2C18, CYP2C19, CYP2D6, CYP2E1, CYP2F1, CYP2J2, CYP2R1, CYP2S1, CYP2U1, CYP2W1 CYP3 Metabolismo de drogas y esteroides (incluyendo testosterona) 1 subfamilia, 4 genes, 2 pseudogenes CYP3A4, CYP3A5, CYP3A7, CYP3A43 CYP4 Metabolismo del ácido araquidónico 6 subfamilias, 11 genes, 10 pseudogenes CYP4A11, CYP4A22, CYP4B1, CYP4F2, CYP4F3, CYP4F8, CYP4F11, CYP4F12, CYP4F22, CYP4V2, CYP4X1, CYP4Z1 CYP5 Tromboxano A2 sintetasa 1 subfamilia, 1 gen CYP5A1 CYP7 Biosíntesis de las sales biliares (7-alpha hidroxilasa del núcleo esteroideo) 2 subfamilias, 2 genes CYP7A1, CYP7B1 CYP8 Variada 2 subfamilias, 2 genes CYP8A1 (prostaciclin sintetasa), CYP8B1 (biosíntesis de sales biliares) CYP11 Biosíntesis de esteroides 2 subfamilias, 3 genes CYP11A1, CYP11B1, CYP11B2 CYP17 Biosíntesis de esteroides 17-alfa hidroxilasa 1 subfamilia, 1 gen CYP17A1 CYP19 Biosíntesis de esteroides 1 subfamilia, 1 gen CYP19A1 CYP20 Desconocida 1 subfamilia, 1 gen CYP20A1 CYP21 Biosíntesis de esteroides 2 subfamilias, 2 genes, 1 pseudogen CYP21A2 CYP24 Degradación de la vitamina D 1 subfamilia, 1 gen CYP24A1 CYP26 Hidroxilasa del ácido retinóico 3 subfamilias, 3 genes CYP26A1, CYP26B1, CYP26C1 CYP27 Variada 3 subfamilias, 3 genes CYP27A1 (biosíntesis de sales biliares), CYP27B1 (vitamina D3 1-alfa hydroxylase), CYP27C1 (función desconocida) CYP39 7-alfa hidroxilación del 24-hidroxicolesterol 1 subfamilia, 1 gen CYP39A1 CYP46 Colesterol 24-hidroxilasa 1 subfamilia, 1 gen CYP46A1 CYP51 Biosíntesis del colesterol 1 subfamilia, 1 gen, 3 pseudogenes CYP51A1 (lanosterol 14-alfa demetilasa) CYP en otros animales
El número de isoenzimas encontradas en algunos animales no coincide con el de los humanos. Así, por ejemplo, en los ratones se han hallado 101 CYP, y es posible que el erizo de mar presente hasta 120. Las áreas más investigadas están en relación con el metabolismo de sustancias tóxicas, del tipo de las aminas heterocíclicas o los hidrocarburos poliaromatizados. Los CYP específicos de estos animales explican las diferentes susceptibilidades a ciertos tóxicos.
Se están estudiando con intensidad los CYP de ratones, ratas, perros y, algo menos, los del pez cebra con el objeto de favorecer el uso de estos modelos orgánicos en el descubrimiento de drogas y en toxicología.
Igualmente se hacen estudios en insectos para investigar la resistencia a pesticidas.
Bioquímica
El sitio activo del citocromo P450 contiene un centro hierro asociado al grupo hemo. El hierro está enlazado a la proteína P450 por medio de un ligando de tiolato que proviene de un residuo de cisteína. Esa cisteína y otros residuos circunvecinos (RXCXG) son altamente conservados entre los CYP conocidos,[7] queriendo decir que existe poca variedad entre un CYP y otro en su sitio de unión con el hierro. Debido a la gran variedad de reacciones catalizadas por los CYP, sus actividades y propiedades varían entre un miembro y el otro en muchos aspectos. Las principales propiedades de una enzima P450 incluyen:
- El estado en reposo de la proteína contiene un grupo Fe3+ (oxidado).
- La unión de un sustrato inicia el transporte de electrones y los enlaces al oxígeno.
- Los electrones son donados al CYP por otra proteína, bien sea un citocromo P450 reductasa, ferredoxina o citocromo b5, con el fin de reducir el hierro del hemo.
- El oxígeno molecular se une con y es reducido por el hierro del hemo.
- Un oxidante unido al hierro, oxida el sustrato bien sea a un alcohol o a un epóxido, regenerando es estado de reposo del CYP.
Referencias
- ↑ International Union of Pure and Applied Chemistry. "cytochrome P450". «Compendium of Chemical Terminology» Internet edition (en inglés). Danielson P (2002). «The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans». Curr Drug Metab 3 (6): pp. 561-97. PMID 12369887.
- ↑ Klingerberg M. Arch Biochem Biophys 1958;75:376-86.
- ↑ Garfinkel D. Arch Biochem Biophys 1958;77:493-509.
- ↑ Omura T, Sato R. J Biol Chem 1964;239:2370-8.
- ↑ Omura T, Sato R. J Biol Chem 1964;239:2379-85.
- ↑ «NCBI sequence viewer». Consultado el 19-11-2007.
- ↑ a b Nelson D (2003). Cytochrome P450s in humans. Retrieved May 9, 2005.
- ↑ «"P450 Table"».
Categorías:- Citocromo P450
- Farmacocinética
- Hemoproteínas
- Proteínas integrales de membrana
Wikimedia foundation. 2010.