- Dioxano
-
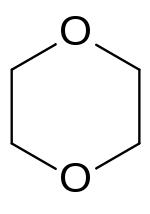
El dioxano (más correctamente el 1,4-dioxano, ya que existe también los isómeros 1,2-dioxano y 1,3-dioxano, que sólo varían en la posición de los átomos de oxígeno) es un éter cíclico con la fórmula C4H8O2 con un esqueleto de 4 átomos de carbono y 2 átomos de oxígeno en posiciones opuestas dentro de un hexágono. En condiciones normales se trata de un líquido volátil e incoloro. Es completamente miscible con el agua, etanol y éter.
Contenido
Propiedades fisicoquímicas
- Fórmula: C4H8O2
- Masa molecular: 136,2 g/mol
- Densidad: 1,0337 g/ml
- Punto de fusión: 11,8 ºC
- Punto de ebullición: 102 ºC
- Densidad óptica: nD20 = 1,4224
- Punto de ignición: 180 ºC
- Punto de inflamación: 12 ºC
- Nº CAS: 123-91-1
- LD50: 5200 mg/kg (rata, oral); 7378 mg/kg (conejo)
- Limites explosivos: 1,9-22,5 % Vol en aire
- Concentración máxima permitida en lugares de trabajo: 20 ppm (antes 50 ppm)
Síntesis
El dioxano se sintetiza a partir de etileno convirtiéndolo en óxido de etileno. A partir de este se genera etilenglicol por hidrólisis y el etilenglicol dimeriza en una reacción de condensación catalizada por ácido.
El dioxano es un subproducto no deseado en la síntesis de algunas sustancias tensioactivas. Su presencia en champús ha iniciado polémicas.
Aplicaciones
El dioxano se utiliza sobre todo como disolvente. Debido a las dos funciones dadores puede disolver algunas sales inorgánicas que facilita su reacción en disolución. Puede ser considerado el éter de corona más sencillo. El dioxano puede sintetizarse también a partir del oxirano.
Precauciones
Los vapores del dioxano forman con el aire mezclas explosivas. En presencia de luz y oxígeno se forman hidroperóxidos que son menos volátiles que el propio dioxano y pueden dar lugar a fuertes explosiones si se destila. Se sospecha que el dioxano es cancerígeno. En experimentos con animales se ha observado un aumento de incidencias aplicando 10 - 100 mg/kg día tras saturar el metabolismo normal de dioxano. En concentraciones elevadas actúa además sobre el sistema nervioso central y provoca daños renales.
El dioxano puede reaccionar violentamente con agentes oxidantes, hidruro de litio aluminio y ácidos fuertes.
Enlaces externos
Categorías:- Éteres cíclicos
- Carcinógenos
Wikimedia foundation. 2010.