- Éter (química)
-
 Metil terbutil éter.
Metil terbutil éter.
En química orgánica y bioquímica, un éter es un grupo funcional del tipo R-O-R', en donde R y R' son grupos alquilo, estando el átomo de oxígeno unido y se emplean pasos intermedios:
- ROH + HOR' → ROR' + H2O
Normalmente se emplea el alcóxido, RO-, del alcohol ROH, obtenido al hacer reaccionar al alcohol con una base fuerte. El alcóxido puede reaccionar con algún compuesto R'X, en donde X es un buen grupo saliente, como por ejemplo yoduro o bromuro. R'X también se puede obtener a partir de un alcohol R'OH.
- RO- + R'X → ROR' + X-
Al igual que los ésteres, no forman puentes de hidrógeno. Presentan una alta hidrofobicidad, y no tienden a ser hidrolizados. Los éteres suelen ser utilizados como disolventes orgánicos.
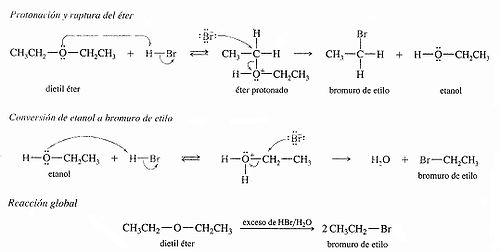
Suelen ser bastante estables, no reaccionan fácilmente, y es difícil que se rompa el enlace carbono-oxígeno. Normalmente se emplea, para romperlo, un ácido fuerte como el ácido yodhídrico, calentando, obteniéndose dos halogenuros, o un alcohol y un halogenuro. Una excepción son los oxiranos (o epóxidos), en donde el éter forma parte de un ciclo de tres átomos, muy tensionado, por lo que reacciona fácilmente de distintas formas.
El enlace entre el átomo de oxígeno y los dos carbonos se forma a partir de los correspondientes orbitales híbridos sp³. En el átomo de oxígeno quedan dos pares de electrones no enlazantes.
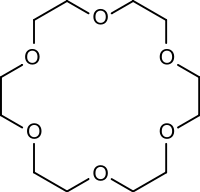
Los dos pares de electrones no enlazantes del oxígeno pueden interaccionar con otros átomos, actuando de esta forma los éteres como ligandos, formando complejos. Un ejemplo importante es el de los éteres corona, que pueden interaccionar selectivamente con cationes de elementos alcalinos o, en menor medida, alcalinotérreos.
Contenido
Dietil éter
El término "éter" se utiliza también para referirse solamente al éter llamado "dietiléter" (según la IUPAC en sus recomendaciones de 1993 "etoxietano"), de fórmula química CH3CH2OCH2CH3. El alquimista Raymundus Lullis lo aisló y subsecuentemente descubrió en 1275. Fue sintetizado por primera vez por Valerius Cordus en 1540. Fue utilizado por primera vez como anestésico por Crawford Williamson Long el 30 de marzo de 1842.
Éteres corona
Hay éteres que contienen más de un grupo funcional éter (poliéteres) y algunos de éstos forman ciclos; estos poliéteres se denominan éteres corona.
Pueden sintetizarse de distintos tamaños y se suelen emplear como ligandos, para complejar compuestos de este tipo. Suelen servir como transporte de cationes alcalinos para que puedan atravesar las membranas celulares y de esta forma mantener las concentraciones óptimas a ambos lados. Por esta razón se pueden emplear como antibióticos, como por ejemplo, la valinomicina.
Otros compuestos relacionados son los criptatos, que contienen, además de átomos de oxígeno, átomos de nitrógeno. A los criptatos y a los éteres corona se les suele denominar "ionóforos".
Poliéteres
Se pueden formar polímeros que contengan el grupo funcional éter. Un ejemplo de formación de estos polímeros:
- R-OH + n(CH2)O → R-O-CH2-CH2-O-CH2-CH2-O-CH2-CH2-O-..
Los poliéteres más conocidos son las resinas epoxi, que se emplean principalmente como adhesivos. Se preparan a partir de un epóxido y de un dialcohol.
 Una resina epoxi
Una resina epoxiNomenclatura
- La nomenclatura de los éteres según las recomendaciones de 1993 de la IUPAC (actualmente en vigencia) especifican que estos compuestos pertenecientes al grupo funcional oxigenado deben nombrarse como alcoxialcanos, es decir, como si fueran sustituyentes. Se debe especificar al grupo funcional éter como de menor prioridad frente a la mayoría de cadenas orgánicas. Cada radical éter será acompañado por el sufijo oxi.
- Un compuesto sencillo, como por ejemplo CH3-O-C6H6 según las normas de la IUPAC se llamaría:
- metoxibenceno
- La nomenclatura tradicional o clásica (también aceptada por la IUPAC y válida para éteres simples) especifica que se debe nombrar por orden alfabético los sustituyentes o restos alquílicos de la cadena orgánica al lado izquierdo de la palabra éter. El compuesto anterior se llamaría según las normas antiguas (ya en desuso) de esta manera:
- fenil metil éter
Los éteres sencillos de cadena alifática o lineal pueden nombrarse al final de la palabra éter el sufijo -ílico luego de los prefijos met, et, but, según lo indique el número de carbonos. Un ejemplo ilustrativo sería el siguiente:
Síntesis de éteres
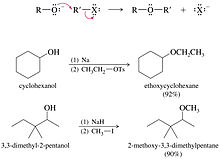
- La síntesis de éteres de Williamson es la síntesis de éteres más fiable y versátil. Este método implica un ataque SN2 de un ion alcóxido a un haluro de alquilo primario no impedido o tosialato. Los haluros de alquilo secundarios y los tosialatos se utilizan ocasionalmente en la síntesis de Williamson, pero hay competencia en las reacciones de eliminación, por lo que los rendimientos con frecuencia son bajos.
- El alcóxido generalmente se obtiene añadiendo Na, K o NaOH al alcohol.
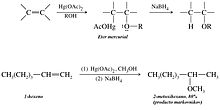
- Síntesis de éteres mediante aloximercuriación-desmercuriación. En el proceso de aloximercuriación-desmercuriación se añade una molécula de un alcohol a un doble enlace de un alqueno. Se obtiene un éter tal como se muestra a continuación:
- Síntesis industrial: deshidratación bimolecular de alcoholes.
Reacciones de éter
Ruptura por HBr y HI
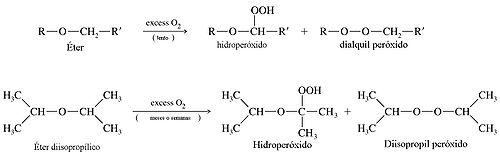
Autooxidación
Usos de los éteres
- Medio para extractar para concentrar ácido acético y otros ácidos.
- Medio de arrastre para la deshidratación de alcoholes etílicos e isopropílicos.
- Disolvente de sustancias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
- Combustible inicial de motores Diésel.
- Fuertes pegamentos
- Desinflamatorio abdominal para después del parto, exclusivamente uso externo.
Enlaces externos
- ILPI Página sobre éteres (en inglés).
- An Account of the Extraordinary Medicinal Fluid, called Aether, (en castellano, Relato del Extraordinario Fluido Médico llamado Eter) por M. Turner, circa 1788, en el Proyecto Gutenberg (en inglés)
Véase también
- Éster
- Dibutil éter
Categorías:- Farmacología
- Éteres
Wikimedia foundation. 2010.