- 2-Metiltetrahidrofurano
-
Propiedades 2-metiltetrahidrofurano
Fórmula molecular C5H10O Masa atómica 86.1 g/mol Viscosidad 0.46 cP (a 25ºC) Densidad 0.85 g/ml (a 20ºC) Punto de ebullición 80ºC Punto de fusión -136ºC Solubilidad en agua 14g /100g agua (a 20ºC) Solubilidad del agua en MeTHF 4.4g Agua /100g MeTHF Parámetro de Hildebrand 16.9 MPa1/2 Presión de vapor 102 mmHg (a 20ºC) Constante dieléctrica 6.97 Calor de vaporización(en Teb) 87.1 cal/g Momento dipolar 1.38 D en:Flash point -11.1ºC Rango de explosión (% vol.) 1.5-8.9 Índice de refracción 1.408 (a 20ºC) Punto de ebullición del azeótropo 71ºC % agua en el azeótropo 10.6 El 2-metiltetrahidrofurano o 2-metiloxolano, es un compuesto orgánico heterocíclico, formado por un anillo de 5 miembros en el que un átomo de carbono ha sido sustituido por un átomo de oxígeno, y un grupo metilo en posición alfa. Es un éter aprótico, de baja viscosidad, líquido a temperatura ambiente, que puede ser obtenido a partir de fuentes naturales renovables. La principal aplicación del MeTHF es actuar como solvente polar en reacciones organometálicas o bifásicas, siendo una alternativa sostenible a otros disolventes convencionales como tetrahidrofurano, dietiléter o diclorometano.
Contenido
Obtención
El 2- metiltetrahidrofurano (MeTHF) se obtiene principalmente a partir de furfural ó 2-furaldehído mediante una reacción de hidrogenación catalítica en dos pasos. En el primero de ellos se hidrogena el furfural para obtener 2-metilfurano (intermedio de reacción) que una vez purificado por destilación, se hidrogena para dar lugar a MeTHF, que finalmente se destila, obteniéndose el producto puro. El reactivo furfural, se obtiene a partir de pentosas presentes de manera natural, en residuos agrícolas como el bagazo del azúcar de caña, o las mazorcas de maiz.
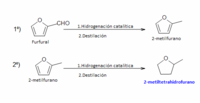 Obtención de 2-metiltetrahidrofurano a partir de furfural
Obtención de 2-metiltetrahidrofurano a partir de furfural
El 2-metiltetrahidrofurano, puede ser producido además usando como reactivo de partida el ácido levulínico, también de origen natural, obteniéndose éste a partir de hexosas derivadas de azúcares presentes en el almidón o en el material lignocelulósico, mediante tratamiento ácido;o bien, partiendo de pentosas, añadiendo una etapa reducción posterior al tratamiento ácido.El ácido levulínico es obtenido también,mediante hidrólisis ácida y posterior deshidratación (ambas etapas a alta temperatura) de residuos provenientes de la industria papelera (celulosa).Propiedades
El MeTHF es un líquido incoloro con un olor dulce o a éter. Presenta una densidad a 20ºC de 0.854 g/mL, y un peso molecular de 86.1g/mol. Al tratarse de una molécula monosustituida de tetrahidrofurano (THF) posee propiedades físicas y químicas relativamente similares, ambas sustancias son bases fuerte de Lewis y presentan una polaridad parecida, siendo la constante dieléctrica del 2-metiltetrahidrofurano de 6.97 y la del THF de 7,58. Mientras el THF es miscible en agua, el 2-metiltetrahidrofurano sólo lo es parcialmente (14 g/100g de agua),siendo la solubilidad del agua en el mismo de 4.4 g/100g de 2-metiltetrahidrofurano.Por otro lado, el valor del parámetro de solubilidad de Hildebrand para el tetrahidrofurano es de 18.7 MPa1/2, mientras que el 2-MeTHF presenta un valor ligeramente inferior, de 16.9 MPa1/2. Estos valores de solubilidad le confieren una ventaja respecto al THF en reacciones organometálicas, permitiendo aislar el producto sin necesidad de usar solventes adicionales. Presenta un punto de ebullición moderado de 80,2 ºC, pero superior al del THF (64ºC), lo que se traduce en una menor pérdida de disolvente en las reacciones a reflujo así como una disminución de los compuestos orgánicos volátiles emitidos. Por otra parte su temperatura de fusión es de -136 ºC; un valor bajo, que sumado a sus también bajos valores de viscosidad (1.85 cP a -70ºC y 0.46 cP a 20ºC) hacen de este compuesto, un excelente disolvente para reacciones que transcurran con temperaturas de reacción bajas. Presenta un "Flash Point"(en:Flash point) de -11,1ºC y un rango de explosión de 1,5 -8.9% vol. Finalmente, el 2-MeTHF presenta un azeótropo con un 10.6% de agua, que permite recuperar el disolvente, relativamente puro, del medio de reacción mediante una simple destilación que no requiere altas temperaturas (60ºC).
Estabilidad y toxicidad
Es un compuesto fácilmente inflamable e irritante (ojos y vías respiratorias) Como la mayoría de los éteres que actúan como disolventes, MeTHF tiende a formar peróxidos explosivos en presencia de oxígeno, si no se le ha proporcionado ningún agente estabilizante.
Se han descrito los siguientes datos toxicológicos de dosis letal:
- LD50 oral = 5720 mg/kg (rata)
- LD50 dérmica = 4500mg/kg (conejo)
Aplicaciones
Reacciones organometálicas
Reacciones de Grignard
Presenta una actividad similar al THF a la hora de formar compuestos de Grignard alquílicos o arílicos, dando mejores resultados en el caso de reactivos bencílicos o arílicos. En cuanto a los reactivos de Grignard halogenados, se ha descrito como los bromados tienden a ser más solubles en MeTHF y los clorados en THF.
Reacciones de Reformatsky
MeTHF es un buen disolvente para este tipo de reacciones ya que la alta solubilidad del bromuro de zinc en el mismo, permite la formación de compuestos de zinc a partir de reactivos litiados o de Grignard
Reacciones de Litiación
Su bajo punto de fusión, su baja viscosidad y su carácter como base de Lewis, convierten al 2-metiltetrahidrofurano en un disolvente adecuado para reacciones de litiación a baja temperatura. LLegando a ser algunos reactivos litiados más estables en este disolvente que en THF.
Reducciones con Hidruros
Debido a la alta solubilidad de LiAlH4 en el 2- metiltetrahidrofurano; se pueden obtener los mismos porcentajes de producto final,que en las reducciones en las que se emplea tetrahidrofurano como disolvente
Reacciones Acopladas
Se ha descrito como el MeTHF de mejores resultados en cuanto a la diastereoselectividad que el THF en las reacciones acopladas con cobre.
Reacciones bifásicas
El MeTHF actua, en ocasiones, como sustituto del diclorometano en reacciones bifásicas tales como alquilaciones, amidaciones y sustituciónes nucleófilas, mostrando una alta reactividad. Como ventajas frente al uso de diclorometano, destacar que su moderado punto de ebullición le confiere mayor resistencia en reacciones con aminas actuando de nucleofilo, y permite mejores separaciones de fases.
Otros
El MeTHF se usa también como:
- - Aditivo en gasolinas y biodiesel.
- - Síntesis de primaquina, medicamento para el tratamiento de la malaria.
Referencias
- Aycock, David F. (2007). «Solvent Applications of 2-Methyltetrahydrofuran in Organometallic and Biphasic Reactions». Organic Process Research & Development 11. p. 156. http://pubs.acs.org/doi/abs/10.1021/op060155c.
- Kerton, Francesca M. (2009). «5» (en Inglés). Alternative Solvents for Green Chemistry. RSC Green Chemistry Series. pp. 108-109. ISBN 9780854041633.. http://www.rsc.org/Shop/books/2009/9780854041633.asp.
- Comanita, Bogdan (2006). «2-MeTHF for greener processes». Speciality Chemicals Magazine. http://www.pschem.com/pdfs/MeTHFPennGreenChemistry.pdf.
Veasé también
Categoría:- Éteres cíclicos
Wikimedia foundation. 2010.