- Disulfuro
-
Disulfuro
En química, el término disulfuro suele hacer referencia a la unión covalente de dos átomos de azufre. El anión disulfuro cuya fórmula química es S22− puede además presentarse en forma gaseosa con una estructura similar al oxígeno gaseoso, además con este término suele hacerse referencia a compuestos que presentan en alguna parte de su estructura el compuesto químico enlace disulfuro, como el disulfuro difenil, C6H5S-SC6H5. Es importante distinguirlo del sulfuro, con número de oxidación -2 y fórmula química S2-. El sulfuro tiene una configuración electrónica de gas noble idéntica a la del Ar.
En los disulfuros, el sulfuro es solamente reducido a un estado de oxidación -1. Su configuración electrónica queda entonces como la del cloro, y, es entonces cuando tiene la misma tendencia que este halógeno, de formar un enlace covalente con otro átomo del mismo elemento. En este caso, un sulfuro formaría un enlace con otro sulfuro para formar disulfuro. En el caso del oxígeno este mismo proceso ocurre cuando se forma el peróxido. En muchos casos, uno de los sulfuros en el disulfuro puede formar un enlace covalente con carbono para formar un compuesto orgánico con un enlace disulfuro o "puente disulfuro". Con un proceso parecido a este también se pueden formar compuestos como los polisulfuros. Además el azufre es capaz de formas estructuras cristalinas tridimensionales tales como la blenda (ZnS), la pirita (FeS2), etc.
Ejemplos
- Disulfuro de hierro: conocido como pirita, (FeS2).
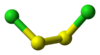
- Disulfuro de dicloro: un líquido destilable, (S2Cl2).
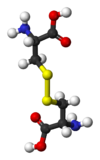
- Cistina: aminoácido, (C6H12O4N2S2).
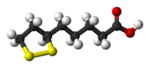
- Ácido lipoico: vitamina, (C8H14O2S2).
- Disulfuro difenil: (C12H10S2).
FeS2 S2Cl2 C6H12O4N2S2 C8H14O2S2 C12H10S2 Confusiones
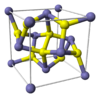
El disulfuro también es usado para referirse a compuestos que contienen dos átomos de azufre en su formula molecular. Esto ocurre porque en estos casos se está usando la nomenclatura sistemática. Por ejemplo, el disulfuro de carbono (CS2), es una molécula con un centro de carbono y dos átomos de azufre ligados al átomo central por enlace doble: S=C=S. Por lo tanto, esta molécula no tiene la misma estructura química que la de los compuestos mencionados anteriormente porque no es una unión de dos átomos de azufre adyacentes. Otro ejemplo es el disulfuro de molibdeno (MoS2), el cual como se puede observar en la figura es un compuesto cristalino.


CS2 MoS2 Categorías: Moléculas diatómicas cargadas | Aniones
Wikimedia foundation. 2010.
