- Gas noble
-
Gas noble
Los gases nobles o gases inertes son un grupo de elementos químicos con propiedades muy similares: bajo condiciones normales, son gases monoatómicos inodoros, incoloros y presentan una reactividad química muy baja. Se sitúan en el grupo 18 (8A) de la tabla periódica (anteriormente llamado grupo 0). Los seis gases nobles que se encuentran en la naturaleza son helio (He), neón (Ne), argón (Ar), Kriptón (Kr), xenón (Xe) y el radioactivo radón (Rn). Hasta ahora tres átomos del siguiente miembro del grupo, el ununoctio (Uuo), han sido sintetizados en un supercolisionador, pero se conoce muy poco de sus propiedades debido a la pequeña cantidad producida y su corta vida media.
Las propiedades de los gases nobles pueden ser explicadas por las teorías modernas de la estructura atómica: a su coraza electrónica de electrones valentes se la considera completa, dándoles poca tendencia a participar en reacciones químicas y solo unos pocos compuestos de gases nobles han sido preparados hasta 2008. El punto de fusión y el de ebullición de cada gas noble están muy próximos, difiriendo en menos de 10 °C; consecuentemente, sólo son líquidos en un rango muy pequeño de temperatura. El xenón reacciona espontáneamente con el flúor y a partir de los compuestos resultantes se han alcanzado otros. También se han aislado algunos compuestos con kriptón.
Neón, argón, kriptón y xenón son obtenidos del aire usando los métodos de licuefacción y destilación fraccionada. El helio es típicamente separado del gas natural y el radón es normalmente aislado a partir del decaimiento radioactivo de compuestos disueltos de radio. Los gases nobles tienen muchas aplicaciones importantes en industrias como iluminación, soldadura y exploración espacial. La combinación helio-oxígeno es usada para respirar en inmersiones de profundidad por debajo de los 55 metros para evitar que los submarinistas sufran el efecto narcótico del nitrógeno, el cual se hace presente a partir de dicha profundidad. Después de verse los riesgos causados por la inflamabilidad del hidrógeno, este fue reemplazado por helio en los dirigibles y globos aerostáticos
Como curiosidad indicar que la discusión científica sobre la posibilidad de licuar estos gases dio lugar al descubrimiento de la superconductividad por el físico holandés Heike Kamerlingh Onnes.
Contenido
Historia
Gas Noble es una traducción del nombre Alemán Edelgas, usado por primera vez en 1898 por Hugo Erdmann[1] para indicar su extremado nivel de reactividad . El nombre hace una analogía con el término "metales nobles", como el oro, el cual fuera asociado con riqueza y nobleza, y también tiene una baja reactividad. Los gases nobles han sido referidos también como Gases Inertes, pero esta etiqueta ha sido desaprobada a medida que los gases nobles son ahora conocidos.[2] Gases Raros es otro término que fue usado,[3] pero este también es incorrecto porque el argón es una parte bastante considerable (0.94% por volumen, 1.3% por masa) de la atmósfera terrestre.[4]
Pierre Janssen y Joseph Norman Lockyer fueron los primeros en descubrir un gas noble el 18 de agosto de 1868 cuando examinaban la cromosfera del Sol, y lo llamaron helio a partir de la palabra griega para el Sol, ήλιος (ílios o helios).[5] Antes de ellos , en 1784, el químico y físico Inglés Henry Cavendish había descubierto que el aire contenía una pequeña proporción de una sustancia menos reactiva que el nitrógeno.[6] Un siglo más tarde, en 1895, Lord Rayleigh descubrió que las muestras de nitrógeno del aire son de diferente densidad del nitrógeno como consecuencia de reacciones químicas. En conjunto con William Ramsay, científico de University College de Londres, Lord Rayleigh postuló que el nitrógeno extraído del aire se encontraba mezclado con otro gas y ejecutó un experimento que consiguió aislar exitosamente un nuevo elemento: argón, derivado del griego argós, "inactivo"[6] Ozima, 2002, p. 1</ref>. A partir de este descubrimiento, notaron que faltaba una clase completa de gases en la tabla periódica. Durante su búsqueda de argón, Ramsay también consiguió aislar helio, por primera vez, al calentar cleveita, un mineral. En 1902, después de aceptar la evidencia de la existencia de los elementos helio y argón, Dmitri Mendeléyev incluyó estos gases nobles como Grupo 0 en su clasificación de elementos, que posteriormente se convertiría en la tabla periódica.[7]
Ramsay continuó con la búsqueda de estos gases usando el método de la destilación fraccionada para separar aire líquido en varios componentes. En 1898, descubrió el kriptón, el neón y el xenón, llamados así a partir del griego κρυπτός (kryptós, "oculto"), νέος (néos, "nuevo"), y ξένος (xénos, "extraño"), respectivamente. Por su parte, el radón fue identificado por primera vez en 1898 por Friedrich Ernst Dorn,[8] y se le llamó emanación de radio, pero no fue considerado como un gas noble hasta 1904, cuando se encontró que sus características eran similares a las de los otros gases nobles.[9] Ese mismo año, Rayleigh y Ramsay recibieron los premios Nobel de Física y Química, respectivamente, por el descubrimiento de los gases nobles.[10] [11]
El descubrimiento de los gases nobles ayudó a la compresión de la estructura atómica. En 1895, el químico francés Heri Moissan intentó infructuosamente producir una reacción entre flúor, el elemento más electronegativo, y argón, uno de los gases nobles. Los científicos fueron incapaces de producir compuestos de argón hasta fines de siglo XX, pero sus intentos ayudaron a desarrollar nuevas teorías de estructura atómica. Aprendiendo a partir de estos experimentos, el físico danés Niels Bohr propuso en 1913 que los electrones en los átomos se encontraban ordenados en capas electrónicas en torno el núcleo y que en el caso de los gases nobles, exceptuando al helio, la capa exterior siempre contenía ocho electrones.[9] En 1916, Gilbert N. Lewis formuló la regla del octeto, la cual concluye que la configuración más estable para cualquier átomo es contar con ocho electrones en la capa exterior; esta configuración produce elementos que no reaccionan con otros, ya que no necesitan más electrones para completar su capa exterior.[12]
No fue hasta 1962 cuando Neil Bartlett descubrió el primer compuesto químico de un gas noble, el hexafluoroplatinato de xenón.[13] Compuestos de otros gases nobles fueron descubiertos poco después: en 1962, el fluoruro de radón[14] y en 1963, el difluoruro de kriptón (KrF2).[15] El primer compuesto estable de argón se reportó en 2000 cuando se formó el fluorohidruro de argón a una temperatura de 40 K (-233.2 °C; -387.7 °F).[16]
En diciembre de 1998, científicos del Joint Institute for Nuclear Research trabajando en Dubna, Rusia, bombardearon plutonio (Pu) con calcio (Ca) para producir un único átomo del elemento 114,[17] el cual es llamado temporalmente ununquadio (Uuq).[18] Experimentos químicos preliminares han indicado que este elemento puede ser el primer elemento transuránico en mostrar propiedades anormales y parecidas a las de los gases nobles, aún cuando es miembro del grupo 14 en la tabla periódica.[19] En octubre de 2006, científicos del Joint Institute for Nuclear Research y Lawrence Livermore National Laboratory sintetizaron exitosamente ununoctio (Uuo), el séptimo elemento en el Grupo 18[20] , al bombardear californio (Cf) con calcio (Ca).[21]
Propiedades físicas y atómicas
Propiedad Gas noble Número atómico 2 10 18 36 54 86 Nombre del elemento Helio Neón Argón Kriptón Xenón Radón Densidad (kg/m3) 0,1785 0,9002 1,7818 3,708 5,851 9,970 Radio atómico (nm) 0,050 0,070 0,094 0,109 0,130 — Punto de ebullición (°C) –268,83 –245,92 –185,81 –151,70 –106,60 –62 Punto de fusión (°C) –272 –248,52 –189,6 –157 –111,5 –71 Los gases nobles cuentan con fuerzas intermoleculares muy débiles y, por lo tanto, tienen puntos de fusión y ebullición muy bajos. Todos ellos son gases monoatómicos bajo condiciones estándar, incluso aquellos elementos que tienen masas atómicas mayores que elementos que se encuentran normalmente en estado sólido. El helio tiene varias propiedades únicas con respecto a otros elementos: tanto su punto de ebullición como el de fusión son menores que los de cualquier otra sustancia conocida; es el único elemento conocido que exhibe superfluidez; es el único elemento que no puede ser solidificado por enfriamiento bajo condiciones estándar, sino que se convierte en sólido bajo una presión de 25 atm (2500 kPa; 370 psi) y 0.95 K (-272.200 °C; -457.960 °F).[22] Los gases nobles hasta el xenón tienen múltiples isótopos estables. El radón no tiene isótopos estables; su isótopo de mayor duración tiene una periodo de semidesintegración de 3.8 días y decae a formar helio y polonio y este último, a su vez, decae a plomo.[9]
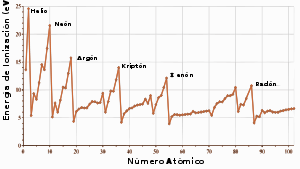 Gráfico de potencial de ionización versus número atómico. Los gases nobles tienen el mayor potencial de ionización para cada periodo.
Gráfico de potencial de ionización versus número atómico. Los gases nobles tienen el mayor potencial de ionización para cada periodo.
El radio atómico de los gases nobles aumenta de un periodo a otro debido al incremento en el número de electrones. El tamaño del átomo se relaciona con varias propiedades. Por ejemplo, el potencial de ionización disminuye a medida que aumenta el radio ya que los electrones de valencia en los átomos más grandes se encuentran más alejados del núcleo y, por lo tanto, no se encuentran ligados tan fuertemente por el átomo. Los gases nobles tienen los mayores potenciales de ionización de cada periodo, lo cuál refleja lo estable que es su configuración electrónica y genera su falta de reactividad química.[23] Sin embargo, algunos de los gases nobles más pesados, tiene potenciales de ionización lo suficientemente bajos para ser comparables a los de otros elementos y moléculas. Bartlett, para crear el compuesto de un gas noble, notó que el potencial de ionización del xenón era similar al de la molécula de oxígeno, por lo que intentó oxidar xenón usando hexafluoruro de platino, un agente oxidante tan fuerte que es capaz de reaccionar con oxígeno.[13] Los gases nobles no pueden aceptar un electrón para formar aniones estables, esto es, tienen afinidad electrónica negativa.[24]
Las propiedades físicas macroscópicas de los gases nobles están determinadas por las débiles fuerzas de Van der Waals que se dan entre átomos. Las fuerzas de atracción aumentan con el tamaño del átomo como un resultado del incremento en la polarizabilidad y el descenso del potencial de ionización. Esto lleva a tendencias grupales sistemáticas: a medida en que se baja por el Grupo 18, el radio atómico, y con él las fuerzas interatómicas, aumentan, produciendo mayores puntos de fusión y de ebullición, entalpía de vaporización y solubilidad. El aumento en densidad se debe al incremento en masa atómica.[23]
Los gases nobles se comportan casi como gases ideales bajo condiciones estándares, pero sus desviaciones a la ley de los gases ideales entregan claves importantes para el estudio de las interacciones moleculares. El potencial de Lennard-Jones, usado frecuentemente para modelar fuerzas intermoleculares, fue deducido en 1924 por John Lennard-Jones a partir de datos experimentales del argón antes de que el desarrollo de la mecánica cuántica entregara las herramientas necesarias para entender las fuerzas intermoleculares a partir de primeros principios.[25] El análisis teórico de estas fuerzas se volvió tratable debido a que los gases nobles son monoatómicos con átomos esféricos, lo que significa que la interacción entre átomos es independiente de la dirección, es decir, es isótropa.
Notas
- ↑ Renouf, Edward (1901-02-15). «Noble gases» Science. Vol. 13. pp. 268–270. DOI 10.1126/science.13.320.268.
- ↑ Ozima, 2002, p. 30
- ↑ Ozima, 2002, p. 4
- ↑ «argon» Encyclopædia Britannica.
- ↑ Oxford English Dictionary (1989), s.v. "helium". Retrieved December 16, 2006, from Oxford English Dictionary Online. Also, from quotation there: Thomson, W. (1872). Rep. Brit. Assoc. xcix: "Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. It seems to indicate a new substance, which they propose to call Helium."
- ↑ a b Ozima 2002, p. 1
- ↑ Mendeleev, 1903, p. 497
- ↑ Partington, J. R. (May de 1957). «Discovery of Radon» Nature. Vol. 179. n.º 4566. pp. 912. DOI 10.1038/179912a0.
- ↑ a b c «Noble Gas» Encyclopædia Britannica.
- ↑ Cederblom, J. E. (1904). «The Nobel Prize in Physics 1904 Presentation Speech».
- ↑ Cederblom, J. E. (1904). «The Nobel Prize in Chemistry 1904 Presentation Speech».
- ↑ Gillespie, R. J.; Robinson, E. A. (January de 2007). «Gilbert N. Lewis and the chemical bond: the electron pair and the octet rule from 1916 to the present day» J Comput Chem. Vol. 28. n.º 1. pp. 87–97. DOI 10.1002/jcc.20545. PMID 17109437.
- ↑ a b Bartlett, N. (1962). «Xenon hexafluoroplatinate Xe+[PtF6]–» Proceedings of the Chemical Society. pp. 218. DOI 10.1039/PS9620000197.
- ↑ Fields, Paul R.; Stein, Lawrence; Zirin, Moshe H. (1962). «Radon Fluoride» Journal of the American Chemical Society. Vol. 84. n.º 21. pp. 4164–4165. DOI 10.1021/ja00880a048.
- ↑ Grosse, A. V.; Kirschenbaum, A. D.; Streng, A. G.; Streng, L. V. (1963). «Krypton Tetrafluoride: Preparation and Some Properties» Science. Vol. 139. pp. 1047–1048. DOI 10.1126/science.139.3559.1047. PMID 17812982.
- ↑ Khriachtchev, Leonid; Pettersson, Mika; Runeberg, Nino; Lundell, Jan; Räsänen, Markku (2000-08-24). «A stable argon compound» Nature. Vol. 406. n.º 406. pp. 874–876. DOI 10.1038/35022551.
- ↑ Oganessian, Yu. Ts. (1999). «Synthesis of Superheavy Nuclei in the 48Ca + 244Pu Reaction» Physical Review Letters. Vol. 83. pp. 3154. American Physical Society. DOI 10.1103/PhysRevLett.83.3154.
- ↑ Woods, Michael (2003-05-06). «Chemical element No. 110 finally gets a name—darmstadtium». Pittsburgh Post-Gazette. Consultado el 2008-06-26.
- ↑ «Gas Phase Chemistry of Superheavy Elements» (PDF). Texas A&M University. Consultado el 2008-05-31.
- ↑ Wilson, Elaine (2005). «Making Meaning in Chemistry Lessons» Electronic Journal of Literacy through Science. Vol. 4. n.º 2.
- ↑ Oganessian, Yu. Ts. (2006-10-09). «Synthesis of the isotopes of elements 118 and 116 in the Plantilla:SimpleNuclide and Plantilla:SimpleNuclide + Plantilla:SimpleNuclide fusion reactions» Physical Review C. Vol. 74. pp. 44602. DOI 10.1103/PhysRevC.74.044602.
- ↑ «Solid Helium». University of Alberta. Consultado el 2008-06-22.
- ↑ a b Greenwood, 1997, p. 891
- ↑ Wheeler, John C. (1997). «Electron Affinities of the Alkaline Earth Metals and the Sign Convention for Electron Affinity» Journal of Chemical Education. Vol. 74. pp. 123–127.; Kalcher, Josef; Sax, Alexander F. (1994). «Gas Phase Stabilities of Small Anions: Theory and Experiment in Cooperation» Chemical Reviews. Vol. 94. pp. 2291–2318. DOI 10.1021/cr00032a004.
- ↑ Mott, N. F. (1955). «John Edward Lennard-Jones. 1894-1954» Biographical Memoirs of Fellows of the Royal Society. Vol. 1. pp. 175–184. DOI 10.1098/rsbm.1955.0013.
Referencias
- Bennett, Peter B.; Elliott, David H. (1998). The Physiology and Medicine of Diving. SPCK Publishing. ISBN 0702024104.
- Bobrow Test Preparation Services (2007-12-05). CliffsAP Chemistry. CliffsNotes. ISBN 047013500X.
- Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements, 2nd edition edición, Oxford:Butterworth-Heinemann. ISBN 0-7506-3365-4.
- Harding, Charlie J.; Janes, Rob (2002). Elements of the P Block. Royal Society of Chemistry. ISBN 0854046909.
- Holloway, John H. (1968). Noble-Gas Chemistry. Londres: Methuen Publishing. ISBN 0412211009.
- Mendeleev, D. (1902–1903). Osnovy Khimii (The Principles of Chemistry), 7th edition edición (en Russian).
- Ozima, Minoru; Podosek, Frank A. (2002). Noble Gas Geochemistry. Cambridge University Press. ISBN 0521803667.
- Weinhold, F.; Landis, C. (2005). Valency and bonding. Cambridge University Press. ISBN 0521831288.
Categoría: Grupo de elementos químicos
Wikimedia foundation. 2010.