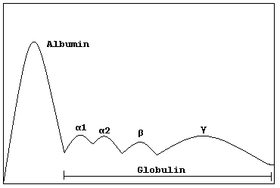
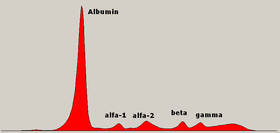
- Electroforesis proteica
-
Electroforesis proteica
La electroforesis proteica es la separación de proteínas mediante la aplicación de un campo eléctrico.
Existen diferentes tipos en función del tipo de separación empleado: electroforesis de zona (separación en función de la carga), isoelectroenfoque y separación por tamaño en tamiz molecular (también aplicable a ácidos nucléicos).
Contenido
Técnicas
Electroforesis de zona: las proteínas son moléculas anfóteras: su carga neta depende del pH del medio. Normalmente, la separación electroforética de proteínas se hace a pH alcalino, en el que la mayoría de las proteínas presentan una carga global negativa. También se puede trabajar a pH ácidos, pero no demasiado bajos, ya que las proteínas precipitan en medio ácido (básicamente se usa en la detección de variantes de la hemoglobina).
Como medio de soporte se puede usar (de más antiguo a más reciente): papel, acetato de celulosa, agarosa, poliacrilamida y electroforesis capilar. La muestra cuyas proteínas se quieren separar se inserta en un medio de soporte y se aplica una diferencia de potencial durante un tiempo determinado para separar las proteínas. Cada proteína migrará más o menos en función de su carga (que también determina hacia qué polo se dirigirá la proteína, ánodo (+) o cátodo (-) y su tamaño. A mayor carga y menor tamaño, más velocidad de migración.
Isoelectroenfoque: en lugar de separar las proteínas en función de su carga a un pH dado, se separan en función de su punto isoeléctrico (pI): el pI es el pH en el que la carga neta de la proteína es nula, y depende de la composición aminoacídica de la proteína. Se crea un gradiente de pH mediante anfolitos (estabilizan el pH a lo largo del gel). Cada proteína migrará hasta alcanzar su pI, punto en el cual precipitará al acumularse (de ahí el nombre, isoelectroenfoque).
También se suelen utilizar acoplados a zimogramas si deseamos determinar el pI de una enzima o en electroforesis bidimensional como primera dimension.
Separación por tamaño: permite separar proteínas y ácidos nucléicos. En el caso de las proteínas, deben ser tratadas con SDS (sodio dodecil sulfato) para que su carga sea negativa y todas migren hacia el ánodo (no es necesario hacer eso con los ácidos nucléicos, ya que tienen carga negativa); la separación se hace en medios de soporte en el que se ha creado un tamiz molecular (matriz), que hace que las proteínas más pequeñas corran más que las más grandes.
Visualización
Una vez separadas las proteínas, deben fijarse y teñirse para poder ser visualizadas. Hay diferentes protocolos en función de lo que se quiere estudiar: fijación por calor o química y tinción en caso de estudios no específicos (proteinograma y electroforesis Hb, por ejemplo) o fijación mediante anticuerpos previa a la tinción en caso de estudiar proteínas específicas (inmunofijación).
Por lo general para la tinción de geles de poliacrilamida se utiliza tinción con plata, tinción de Coomassie o tinción fluorescente. Dependiendo del fin de nuestro análisis. La tinción con plata no es utilizada si se desean hacer análisis por espectrometría de masas (MS) pero es más sensible que la tinción con Azul de Coomassie, por otro lado, la tinción fluorescente es muy sensible y compatible con MS pero los costos de tinción son elevados.
Una tinción sensible y barata es la denominada "Blue Silver" o Coomassie G250[1] . Además, esta tinción es compatible con MS. Esta compuesta por azul de coomassie diluido en una solución coloidal y se utliza agua destilada para destiñir el gel de poliacrilamida.
Aplicaciones
Pueden analizarse las proteínas contenidas en diferentes líquidos biológicos: sangre, plasma (el líquido sanguíneo sin células), suero (plasma sin fibrinógeno), orina, LCR, líquido sinovial, saliva, lágrimas. Así como alimentos, especialmente lácteos y cereales.
Este tipo de análisis electroforético tiene aplicaciones en investigación y en clínica, tanto humana como animal. Además es una técnica muy empleada para el análisis de proteínas alimentarias y últimamente se empleando para realizar genotipado y detección de OMG (organismos modificados genéticamente)
Enlaces internos
Referencias
- ↑ Candiano, G., Bruschi, M., Musante, L., Santucci, L., Ghiggeri, G.M., Carnemolla, B., Orecchia, P., Zardi, L. and Righetti, P.G. (2004). «Blue silver: A very sensitive colloidal Coomassie G-250 staining for proteome analysis.» Electrophoresis,. Vol. 25. n.º 9. pp. 1327 - 1333.
Categoría: Proteínas
Wikimedia foundation. 2010.