- Feruloil esterasa
-
Feruloil esterasa
La feruloil esterasa (EC 3.1.1.73) es una enzima que cataliza la siguiente reacción química.
feruloil-polisacarido + H2O
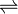 ácido ferúlico + polisacárido
ácido ferúlico + polisacárido
De esta forma, el sustrato es el polisacárido feruloilado (presente en la pared celular de vegetales), liberando el ácido ferúlico al medio.
Esta enzima pertenece a la familia de las hidrolasas, específicamente las que actúan sobre los enlaces ésteres carboxílicos. Forma parte de las enzimas accesorias que degradan el xilano (desramificantes). El nombre sistemático de esta clase de enzima es "4-hidroxi-3-metoxicinamoil hidrolasa". Otros nombres comúnmente usados son FAE, ácido ferúlico esterasa y cinamoil esterasa (genérico).
Cabe destacar que la función que cumple esta enzima no es solo degradar la pared celular vegetal, ya que se ha descrito la presencia de estas proteínas en plantas, cuya función podría ser la de remodelar la pared en las etapas de crecimiento.
Contenido
Clasificación
 Fig.1: Ácidos hidroxicinámicos y sus metil derivados .
Fig.1: Ácidos hidroxicinámicos y sus metil derivados .
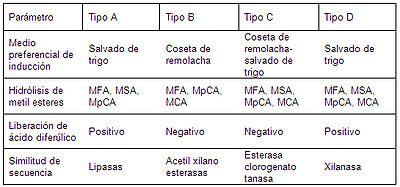
Las FAEs pueden clasificarse según su especificidad de sustrato[1] , donde se determina si son capaces de hidrolizar sustratos sintéticos (metil esteres de ácidos hidroxicinámicos(Fig.1)) y en el alineamiento de su secuencia aminoacidica con otras esterásas. De esta manera se proponen cuatro subclases: Tipo A, B, C y D. La FAE tipo A es activa en metil ferulato (MFA), metil p-cumarato (MpCA), y metil sinapato (MSA); estas FAEs tienen secuencias similares a lipasas y son capaces de hidrolizar diferulatos sintéticos. FAEs tipo B específicamente hidrolizan MFA, MpCA y metil cafeato (MCA), pero no MSA. Estas enzimas no liberan diferulatos y muestran secuencias similares a acetil xilano esterasas de la familia 1. Las enzimas de tipo C y D muestran secuencias similares a xilanasas y otras esterasas; además, estos dos tipos de FAE actúan sobre los 4 metil esteres de ácidos hidroxicinámicos. Sin embargo, las FAEs Tipo C no liberan ácido diferulico de sustratos complejos, mientras que FAEs tipo D si son capaces de hidrolizar dichos dimeros (tabla 1)
Aún falta información y estudio de las distintas clases de feruloil esterasas. Para ello es necesario un estudio detallado de enzimas de distintas fuentes (bacterias, hongos y plantas), analizando su secuencia aminoacídica, su especificidad de sustrato, regioselectividad, constantes cinéticas y estructuras tridimensionales.
Inducción de la enzima
Se pueden utilizar distintas fuentes de carbono (material lignocelulósico) para inducir la producción de esta enzima por parte de los microorganismos cultivados. En general al crecer el microorganismo en sustratos ricos en ácido ferúlico (hemicelulosas y pectinas) se observa una mayor cantidad de actividad feruloil esterásica en los sobrenadantes.
Por otro lado, al suplementar los medios de cultivo con ácido ferúlico (en fuentes complejas de carbono) u otros sustratos de estructura parecida (que presentan un grupo metoxi sustituyendo el carbono 3 del anillo aromático y otro grupo hidroxi en el carbono 4) se observa inducción a nivel génico en A. niger (ref), indicando que la regulación de la expresión a nivel transcripcional y traduccional esta finamente regulada.
No se observa ninguna inducción al crecer los microorganimos en azúcares simples (glucosa, manosa, xilosa, fructosa o arabinosa).
Enzimas descritas
Hasta la fecha se han descrito alrededor de siete feruloil esterasas de distinto tipo (purificadas a homogeneidad y caracterizadas), proveniente de distintos microorganismos (bacterias y hongos).
En la base de datos de Swiss-Prot podemos encontrar.
- FAEA (Q9P979) de Aspergillus awamori.
- FAEA (O42807) de Aspergillus niger.
- FAEA (O42815) de Aspergillus tubingensis.
- FAEB (Q8WZI8) de Aspergillus niger.
- FAEB (Q9HGR3) de Neurospora crassa.
- FAEB (Q9HE18) de Penicillium funiculosum.
- FAEB (Q9Y871) de Piromyces equi.
Sin embargo se ha descrito la presencia de actividad feruloil esterásica y la purificación parcial de una multitud de FAEs en otras especies de hongos, bacterias y plantas.
Estudios estructurales
La estructura tridimensional de FAE-A de A. niger (AnFaeA, Fig.2) ya ha sido publicada[2] El sitio activo contiene una triada catalitica (Ser-His-Asp) característica de la familia de serina proteasas y esterasas, con el residuo de serina localizado en un pentapéptido de secuencia consenso conservada GXSXG[3] . La triada catalitica consiste de Ser133-His247-Asp194.
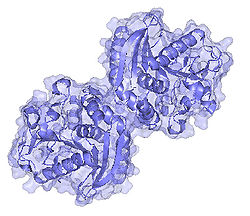 Fig.2: Estructura tridimensional de AnFaeA. (PDB 1USW).
Fig.2: Estructura tridimensional de AnFaeA. (PDB 1USW).
Véase también
Referencias
- ↑ Crepin, V.F, Faulds, C.B. and Connerton, I.F. (2004). «Functional classification of the microbial feruloyl esterases» Applied Microbiology and Biotechnology,. Vol. 63. n.º 6. pp. 647-652. DOI 10.1007/s00253-003-1476-3. PMID 205802.
- ↑ Hermoso, J.A., Sanz-Aparicio, J., Molina, R., Juge, N., Gonzalez, R. and Faulds, C.B. (2004). «The crystal structure of feruloyl esterase A from Aspergillus niger suggests evolutive functional convergence in feruloyl esterase family» J. Mol. Biol.,. Vol. 338. pp. 495-506.
- ↑ Carter, P. and Wells, J.A. (1988). «Dissecting the catalytic triad of a serine protease» Nature,. Vol. 332. pp. 564-568.
Categoría: Enzimas
Wikimedia foundation. 2010.