- Enlace peptídico
-
Enlace peptídico
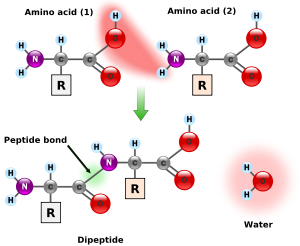
El enlace peptídico es un enlace covalente entre el grupo amino (–NH2) de un aminoácido y el grupo carboxilo (–COOH) de otro aminoácido. Los péptidos y las proteínas están formados por la unión de aminoácidos mediante enlaces peptídicos. El enlace peptídico implica la pérdida de una molécula de agua y la formación de un enlace covalente CO-NH. Es, en realidad, un enlace amida sustituido.
Podemos seguir añadiendo aminoácidos al péptido, pero siempre en el extremo COOH terminal.
Para nombrar el péptido se empieza por el NH2 terminal por acuerdo. Si el primer aminoácido de nuestro péptido fuera alanina y el segundo serina tendríamos el péptido alanil-serina.
Características estructurales del enlace
Podríamos pensar que una proteína puede adoptar miles de conformaciones debidas al giro libre en torno a los enlaces sencillos. Sin embargo, en su estado natural sólo adoptan una única conformación tridimensional que llamamos conformación nativa; que es directamente responsable de la actividad de la proteína.
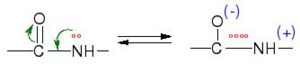
Esto hizo pensar que no podía haber giro libre en todos los enlaces; y efectivamente, mediante difracción de rayos X se vio que el enlace peptídico era más corto que un enlace sencillo normal, porque tiene un cierto carácter (60%) de enlace doble, ya que se estabiliza por resonancia.
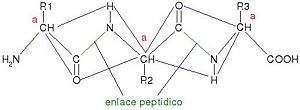
Por esa razón no hay giro libre en torno a este enlace. Esta estabilización obliga a que los 4 átomos que forman en enlace peptídico más los dos carbonos que se encuentran en posición a (marcado con a en la ilustración) con respecto a dicho enlace, se encuentren en un plano paralelo a ello:
Esta ordenación planar rígida es el resultado de la estabilización por resonancia del enlace peptídico. Por ello, el armazón está constituido por la serie de planos sucesivos separados por grupos metileno sustituidos. Esto impone restricciones importantes al número posible de conformaciones que puede adoptar una proteína.
El O carbonílico y el hidrógeno amídico se encuentran en posición trans (uno a cada lado del plano); sin embargo, el resto de los enlaces (N-C y C-C) son enlaces sencillos verdaderos, con lo que podría haber giro. Pero no todos los giros son posibles.
Si denominamos "Φ" al valor del ángulo que puede adoptar el enlace N-C, y "Ψ" al del enlace C-C, sólo existirán unos valores permitidos para Φ y Ψ; y dependerá en gran medida del tamaño del grupo R.
Se producen nuevamente restricciones al giro libre, debido a las características de los grupos R sucesivos.
Véase también
- Proteína
- Síntesis proteica
- Proteólisis
Categorías: Enlace químico | Proteínas
Wikimedia foundation. 2010.