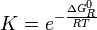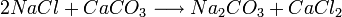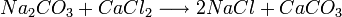- Reacción reversible
-
Reacción reversible
Una reacción reversible es una reacción química. Consideremos por ejemplo la reacción de los reactivos A y B que se unen para dar los productos C y D, ésta puede simbolizarse con la siguiente ecuación química:
Los coeficientes estequiométricos, es decir, el número relativo de moles de cada sustancia que interviene en la reacción se indican como a, b para los reactivos y c, d para los productos, mientras que la doble flecha
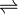 indica que la reacción puede ocurrir en uno u otro sentido, directo e inverso.
indica que la reacción puede ocurrir en uno u otro sentido, directo e inverso.Puesto que la reacción puede proceder en ambas direcciones y el sentido neto de la reacción está definido por la presión, la temperatura y la concentración relativa de reactivos y productos en el medio en que se desarrolla, la definición de reactivos y productos en este tipo de reacciones es convencional y está dada por el tipo de proceso estudiado.
Los reactivos suelen estar en su máxima concentración al principio de la reacción, pero a medida que la reacción evoluciona y la concentración de los productos aumenta, también se incrementa la velocidad de la reacción inversa. Cuando este tipo de reacciones se llevan a cabo para obtener determinado producto suele ser necesario ir separando dicho producto del medio que reacciona a medida que se van introduciendo los reactivos.
Si no existe intervención externa (adición de reactivos, separación de productos o cambio de las condiciones de operación definidas básicamente por la presión y la temperatura) estas reacciones evolucionan espontáneamente hacia un estado de equilibrio en el que la velocidad de formación de productos iguala a la velocidad en que estos se transforman en reactivos. Entonces, en el punto de equilibrio la velocidad neta de reacción, igual a la velocidad de la reacción directa menos la de la reacción inversa, es cero.
En el equilibrio se cumple que:
donde Vrd es la velocidad de reacción directa y Vri es la velocidad de reacción inversa, ambas en concentración por unidad de tiempo.
Las velocidades de reacción directa e inversa son proporcionales a las concentraciones involucradas (un tratamiento riguroso requiere el empleo de actividades en lugar de concentraciones), tendremos:
y
donde kd y ki son las constantes de reacción derecha e inversa y dependen solo de la temperatura, [A], [B], [C] y [D] representan las concentraciones de A, B, C, y D. Puesto que en el equilibrio las velocidades se igualan:
de donde
El subíndice e, de las concentraciones, significa que han alcanzado el equilibrio. Los supraíndices indican que cada concentración está afectada por su coeficiente estequiométrico como potencia.
El cociente
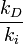 es una cantidad que depende de la temperatura del sistema reaccionante, y se la denomina la constante de equilibrio químico K (constante pues; aunque depende de la temperatura, no depende de las concentraciones de reactivos y productos).
es una cantidad que depende de la temperatura del sistema reaccionante, y se la denomina la constante de equilibrio químico K (constante pues; aunque depende de la temperatura, no depende de las concentraciones de reactivos y productos).De las ecuaciones fundamentales de la termodinámica se deduce que:
donde
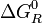 es la energía libre de Gibbs normal de la reacción y su valor se calcula en función de propiedades termodinámicas de los reactivos y productos de la reacción.Véase también: Deducción de la constante de equilibrio
es la energía libre de Gibbs normal de la reacción y su valor se calcula en función de propiedades termodinámicas de los reactivos y productos de la reacción.Véase también: Deducción de la constante de equilibrioEjemplos de reacciones reversibles son las soluciones de ácidos y bases débiles: Cuando un ácido o base débil se mezcla con agua, se forman cationes oxonio (H3O+) y aniones hidroxilo (OH−), como productos de reacción, que se recombinan con el resto de producto ácido o básico para dar nuevamente el ácido o base originales y agua.
Reseña histórica
El concepto de reacción reversible fue introducido por Berthollet en 1803, después de observar la formación de cristales de carbonato de sodio en la orilla de una salina.
Berthollet reconoció esta reacción como la inversa de la conocida reacción
Hasta entonces se pensaba que las reacciones químicas ocurrían siempre en un solo sentido. Berthollet dedujo que el exceso de sal (cloruro sódico, NaCl) en el lago fue lo que inclinó la reacción hacia su sentido inverso, formando carbonato de sodio. En 1864, Waage y Guldberg formularon la ley de acción de masas, que cuantifica las observaciones de Berthollet. Entre 1884 y 1888 Le Châtelier y Braun formularon el Principio de Le Chatelier que extendió esta idea contemplando el efecto de otros factores además de los cambios en la concentración, como son los cambios en la presión y la temperatura, y su efecto sobre el equilibrio químico de la reacción.
Véase también
- Reacción irreversible
- Principio de Le Châtelier
- Equilibrio químico
- Equilibrio dinámico
- Proceso reversible
Categorías: Equilibrio químico | Reacciones químicas
Wikimedia foundation. 2010.

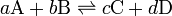
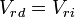
![V_{rd} = k_d [A]^a [B]^b \,\!](/pictures/eswiki/48/0019aee45e7f1a521b6d24cc730201a0.png)
![V_{ri} = k_i [C]^c [D]^d \,\!](/pictures/eswiki/99/c7077484019e67a00a2a060aeedb42e6.png)
![k_{d} [A]_e^a [B]_e^b = k_i [C]_e^c [D]_e^d \,\!](/pictures/eswiki/57/9f8dc0def260f856d39a232d2f946423.png)
![\frac{k_{d}}{k_{i}}= \frac {[C]_{e}^{c} [D]_{e}^{d}}{[A]_{e}^{a} [B]_{e}^{b}}](/pictures/eswiki/98/b56f2b298b33400557428c225c3151b3.png)