- Reacción de Doebner-Miller
-
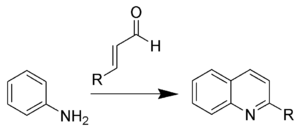
La reacción de Doebner-Miller es una reacción orgánica de una anilina con un compuesto carbonílico α,β-insaturado para formar quinolinas.[1] [2] [3] [4]
Esta reacción también es conocida como la síntesis de quinolinas de Skraup-Doebner-Von Miller, y es denominada así en honor al químico checo Zdenko Hans Skraup (1850-1910), y los alemanes Oscar Döbner (Doebner) (1850-1907) y Wilhelm von Miller (1848-1899). Cuando un compuesto de carbonilo α,β-insaturado se prepara in situ a partir de dos compuestos carbonílicos (vía una condensación aldólica), la reacción es conocida como el método de Beyes para las quinolinas.
La reacción es catalizada por un ácido de Lewis tal como el tetracloruro de estaño y el triflato de escandio(III) o un ácido de Brønsted como el ácido perclórico, amberlita y yodo.
Mecanismo de reacción
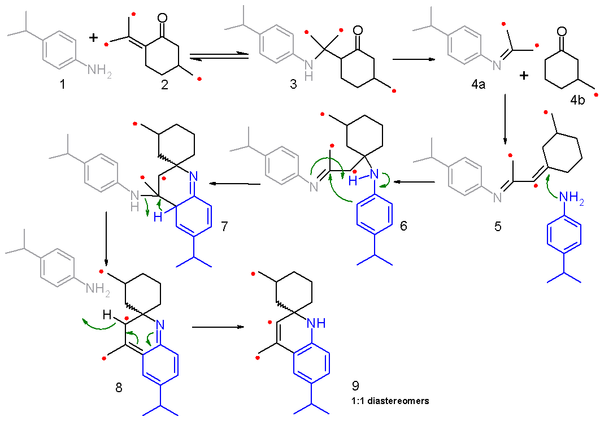
El mecanismo de reacción para esta reacción y la síntesis de Skraup relacionada a ella es materia de debate. Un estudio del 2006[5] propone un mecanismo de fragmentación-recombinación basado en experimentos de dispersión con carbono-14. En este estudio, se hizo reaccionar 4-isopropilanilina 1 con una mezcla (50:50) de pulgona ordinaria y el isómero enriquecido con 14C 2 y el mecanismo de reacción está delineado en el esquema 2 con el carbono marcado identificado con un punto rojo. El primer paso es una adición nucleofílica conjugada de la amina con el enol a una aminocetona 3 en una reacción reversible. Este intermediario se fragmenta a la imina 4a y la ciclohexanona saturada 4b en una reacción no reversible, y ambos fragmentos se recombinan en una reacción de condensación para formar la imina conjugada 5. En el siguiente paso, 5 reacciona con una segunda molécula de anilina en una adición nucleofílica conjugada para formar la imina 6 y subsecuente adición electrofílica y transferecia de un protón que conduce a 7. La eliminación de una molécula de anilina por medio de 8 y rearomatización conduce al producto final 9. Debido a que los α-amino protones no están disponibles en este compuesto modelo, la reacción no conduce a la quinolina característica.
La fragmentación a 4a y 4b es la clave del mecanismo porque explica los resultados de distribución isotópica. En la reación, sólo la mitad del reactivo pulgona (2) está marcado y al recombinarse con un fragmento de imina marcada puede reaccionar con otro fragmento de cetona marcada o sin marcar, y del mismo modo un fragmento de cetona marcada puede reaccionar con un fragmento de imina marcada o sin marcar. La distribución resultante del producto está confirmada por espectrometría de masas del producto final 9.[6]
Referencias
- ↑ Doebner, O.; Miller, W. v. Ber. 1881, 14, 2812.
- ↑ Doebner, O.; Miller, W. v. Ber. 1883, 16, 1664 & 2464.
- ↑ Doebner, O.; Miller, W. v. Ber. 1884, 17, 1712.
- ↑ Bergström, F. W. Chem. Rev. 1944, 35, 153. (Review)
- ↑ On the Mechanism of the Skraup-Doebner-Von Miller Quinoline Synthesis Scott E. Denmark and Srikanth Venkatraman J. Org. Chem.; 2006; 71(4) pp 1668 - 1676; Resumen
- ↑ cada pico iónico M, M+1, M+2, M+3 está igualmente representado y dadas las condiciones de reacción, la pulgona misma no se fragmenta en ausencia de imina.
Véase también
- Síntesis de quinolinas de Combes
- Síntesis de quinolinas de Doebner
- Síntesis de quinolinas de Gould-Jacobs
- Síntesis de quinolinas de Knorr
- Síntesis de quinolinas de Riehm
- Síntesis de quinolinas de Skraup
- Síntesis de quinolinas de Pfitzinger
- Síntesis de quinolinas de Friedländer
- Síntesis de quinolinas de Conrad-Limpach
- Síntesis de quinolinas de Camps
- Este artículo fue creado a partir de la traducción del artículo Doebner-Miller reaction de la Wikipedia en inglés, bajo licencia Creative Commons Atribución Compartir Igual 3.0 y GFDL.
Categoría:- Reacciones químicas orgánicas
Wikimedia foundation. 2010.