- Reglas de Cahn-Ingold-Prelog
-
Las reglas de Cahn-Ingold-Prelog, usadas en química orgánica, establecen la prioridad de los sustituteyentes unidos a un átomo, habitualmente carbono. Esto nos sirve para designar de forma inequívoca la configuración, la disposición espacial, de estereoisómeros tales como enantiómeros y diastereoisómeros o en el caso de los alquenos en la notación Z/E.
Este sistema fue desarrollado por los químicos Robert S. Cahn, Christopher Ingold y Vladimir Prelog.
Contenido
Reglas de prioridad
Las prioridades de los grupos unidos a un átomo se establecen siguiendo unas reglas de prioridad (o reglas de secuencia):
- La prioridad se establece según el número atómico del átomo sustituyente. Un átomo tiene prioridad sobre otros de número atómico menor. Así pues, el hidrógeno es el que tiene una prioridad más baja. En caso de isótopos el de mayor masa atómica tiene prioridad.
- Si entre dos o más sustituyentes existe coincidencia en el número atómico del átomo unido directamente a la posición de la cual se quiere establecer su configuración, se sigue a lo largo de la cadena de cada sustituyente hasta poder asignar un orden de prioridades.
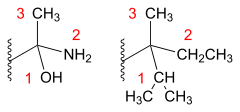
Por ejemplo, la prioridad del grupo metilo (-CH3) es menor que la del grupo etilo (-CH2CH3), ya que el metilo solo tiene átomos de hidrógeno unidos al primer carbono mientras que el etilo tiene un átomo de carbono con un número atómico mayor y por tanto con una prioridad más alta.
H H H | | | -C-H < -C-C-H | | | H H H
Siempre se empieza comparando entre los átomos de máxima prioridad que cuelgan del primer átomo, ganando el que tenga un mayor número atómico. En caso de empate se sigue con los siguientes en número atómico. En el ejemplo, el átomo de oxígeno del hidroximetilo (-CH2OH) se impone sobre el átomo de carbono del isopropilo (-CH(CH3)2).
H CH3 | | -C-OH > -C-CH3 | | H H
El etilo (-CH2CH3) tiene menor prioridad que el isopropilo (-CH(CH3)2), ya que este último tiene un átomo más de carbono unido al primero, deshaciendo el empate inicial entre átomos de carbono ya que el segundo átomo de carbono del isopropilo tiene un número atómico más elevado que el siguiente átomo del etilo que es un hidrógeno. Esto es, el mayor número de sustituyentes de máxima prioridad (con mayor número atómico) ha decidido en favor del isopropilo. Del mismo modo, el 2-metilpropilo (-CH2CH(CH3)2) es de mayor prioridad que el propilo (-CH2CH2CH3).
H CH3 H CH3 H H | | | | | | -C-CH3 < -C-CH3 -C-C-CH3 > -C-C-CH3 | | | | | | H H H H H H
La prioridad se establece en el primer punto de discrepancia que se encuentre, el más cercano al primer átomo del sustituyente, siendo intrascendente el resto de estructura. Esto es, en el ejemplo, el grupo 2-hidroxietilo (-CH2CH2OH), a pesar de contener en su estructura un átomo de oxigeno con un número atómico más elevado, es de menor prioridad que el isopropilo (-CH(CH3)2), ya que en éste del primer carbono cuelgan dos átomos de carbono mientras que en el 2-hidroxietilo sólo uno.
H CH3 | | -C-CH2OH < -C-CH3 | | H H
En caso de llegar a un punto de ramificación a lo largo de una cadena, se escoge la rama de mayor prioridad para seguir, si fuera necesario, con el análisis a lo largo de ésta.
- Los dobles y triples enlaces se consideran de la siguiente manera:
-CH=CHR se considera como -CH-CHR | | C C
C C | | -C≡CR se considera como -C-C-R | | C C
R R | | -C=O se considera como -C-O | O-C
Nomenclatura R/S
Los descriptores R/S permiten indicar en un compuesto orgánico la configuración, (la disposición espacial de los sustituyentes), de un carbono o centro quiral, estereocentro o centro estereogénico, que es el caso de un átomo de carbono con cuatro sustituyentes diferentes.
Se añade R o S entre paréntesis como prefijo delante del nombre de la molécula orgánica. En caso de ser más de uno el centro estereogénico, separados por coma se indica el descriptor R o S de cada uno, precedido del número o localizador que identifica su posición.
Identificación de la configuración R o S
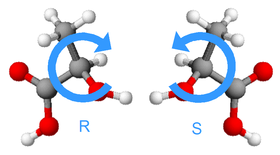
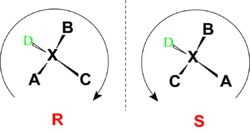
- Asignar mediante números o letras la prioridad a los sustituyentes desde el de mayor prioridad al de menor.
- El sustituyente de inferior prioridad se sitúa lo más alejado posible del observador.
- Observar en qué sentido es el movimiento para ir desde el grupo de más alta prioridad al tercero pasando por el segundo. Si se hace hacia la derecha, en el sentido de las agujas del reloj, la configuración es R (del latín rectus, derecho). Si se hace hacia la izquierda, en el sentido contrario a las agujas del reloj, la configuración es S (del latín sinister, izquierdo).
Ejemplos
Bibliografía
- K. Peter C. Vollhardt (1994). Química Orgánica. Barcelona: Ediciones Omega S.A.. ISBN 84-282-0882-4.
Wikimedia foundation. 2010.