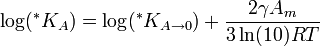- Equilibrio de solubilidad
-
Equilibrio de solubilidad
Equilibrio de solubilidad es cualquier tipo de relación de equilibrio químico entre los estados sólido y disuelto de un compuesto en la saturación.
Kps significa "producto de solubilidad" o "equilibrio de solubilidad". Es la constante de equilibrio de la reacción en la que una sal sólida se disuelve para dar sus iones constituyentes en solución.
Los equilibrios de solubilidad implican la aplicación de los principios químicos y las constantes para predecir la solubilidad de sustancias en condiciones específicas (porque la solubilidad es sensible a las condiciones, mientras que las constantes lo son menos).
La sustancia que se disuelve puede ser un sólido orgánico como el azúcar o un sólido iónico como la sal de mesa. La principal diferencia es que los sólidos iónicos se disocian en sus iones constituyentes, cuando se disuelven en agua. La mayor parte de las veces, el agua es el disolvente de interés, aunque los mismos principios básicos son aplicables a cualquier disolvente.
Contenido
Compuestos no iónicos
La disolución de un "sólido orgánico" puede describirse como un equilibrio entre la sustancia en sus formas sólida y disuelta:
Una expresión del equilibrio para esta reacción puede escribirseser escrita, como para cualquier reacción química (productos dividio por los reactivos):
donde K se denomina constante de equilibrio (o constante de solubilidad). Las llaves indican la actividad. La actividad de un sólido puro es, por definición, la unidad. Si la actividad de la sustancia en disolución es constante (es decir, no afectada por cualesquiera otros solutos que puedan estar presentes) se puede reemplazar por la concentración, aunque omitiendo las dimensiones de las medidas de concentración utilizadas. Las actividades son cantidades adimensionales que se obtienen dividiendo la medida de la concentración por un estándar de concentración distinta de cero.
Los corchetes significan la concentración molar, que se denominada molaridad con el símboloM).
Esta expresión señala que el agua en equilibrio con azúcar sólido contiene una concentración igual aK. Para el azúcar de mesa (sacarosa) a 25 °C, K = 1,971 cuando la concentración estándar se toma como 1 mol/L. (Esta solución es muy concentrada, la sacarosa es muy soluble en agua.). Esta es la máxima cantidad de azúcar que puede disolverse a 25 °C, la solución está "saturada". Si la concentración es inferior a la saturación, puede disolverse más cantidad de azúcar hasta que la solución alcanza la saturación, o hasta todo el sólido se haya consumido. Si hay más cantidad de azúcar presente que la permitida por la expresión de la constante de solubilidad, entonces la disolución está "sobresaturada" y sólido precipitará hasta que se alcance la concentración de saturación. Este proceso puede ser lento, la expresión de la constante de equilibrio describe las concentraciones cuando el sistema de alcance el equilibrio, no lo rápido que se llega al mismo.
Compuestos iónicos
Los compuestos iónicos normalmente se disocian en sus iones constituyentes, cuando se disuelven en agua. Por ejemplo, para el sulfato de calcio:
Como en el ejemplo anterior, la expresión del equilibrio es:
donde “K” es la llamada constante de equilibrio (o solubilidad) y las llaves indican la actividad.
La actividad de un sólido puro es, por definición, igual a uno. Cuando la solubilidad de la sal es muy baja los coeficientes de actividad de los iones en solución también serán iguales a uno y esta expresión se reduce a la expresión del “producto de solubilidad”.
Esta expresión dice que una solución acuosa en equilibrio con sulfato de calcio sólido ("saturada") el sulfato de calcio sólido tiene unas las concentraciones de estos dos iones tal que su producto iguala a 'Ksp; para el sulfato de calcio 'Ksp = Plantilla:Val. Si la solución contiene sólo sulfato de calcio, y las condiciones son tales que las especies disueltas son sólo CaPlantilla:Chem/su1m1 Plantilla:Y chem, entonces la concentración de cada ion (y la solubilidad total del sulfato de calcio) es
Cuando una solución se disocia en partes desiguales como en:
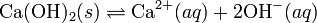 ,
,
entonces la determinación de la solubilidad de la Ksp es ligeramente más difícil:
Llamando "x" a la concentración de iones Ca2+ en moles por litro, que es equivalente a la solubilidad del hidróxido de calcio:
Generalmente, para la reacción de disolución:
la solubilidad y el producto de solubilidad están relacionados mediante la ecuación:
- donde:
- n es el número total de moles en el lado derecho, p.e., x+y, sin dimensiones
- x es el número de moles del catión, sin dimensiones
- y es el número de moles del anión, sin dimensiones
- Ksp es el producto de solubilidad, (mol/kg)n
- C es la solubilidad de A expresada como cociente de una masa del soluto A en una cantidad de disolvente (kg de A por kg de disolvente)
- MM es la masa molecular del compuesto A, kg/mol.
Así mismo, la anterior ecuación asume que la disolución ocurre en el disolvente puro (ningún efecto de ion común), que no hay complejación o hidrólisis (p. ej., sólo iones B p+ y C q- están presentes en solución), y que las concentraciones son suficientemente bajas para que los coeficientes de actividad se tomen como la unidad.
Efecto del ion común
El efecto del ion común se refiere al hecho de que el equilibrio de solubilidad cambia de acuerdo con el Principio de Le Chatelier. En el anterior ejemplo, la adición de iones sulfato a una solución saturada de sulfato de calcio causa que precipite CaSO4 hasta que la concentración de los iones en solución sea tal que vuelvan a satisfacer el producto de solubilidad. (La adición de iones de sulfato puede, por ejemplo, lograrse por añadiendo una sal muy soluble, como Na2 SO4.)
Efecto salino
El efecto salino [1] se refiere al hecho que la presencia de otra sal, aun cuando no haya ningún ion común, tiene un efecto sobre la fuerza iónica de la solución y por lo tanto sobre los coeficientes de actividad de los iones, de modo que la solubilidad cambia aun cuando la Ksp permanezca constante (asumiendo que la actividad de los sólidos continua siendo la unidad).
Efecto de la especiación
En disolución, sales típicamente iónicas se disocian en sus iones constituyentes, pero los iones pueden formar otras especies en solución. En la especiación, la solubilidad aumenta siempre, aunque el producto de solubilidad no cambia. Por ejemplo, el equilibrio de solubilidad del carbonato de calcio puede expresarse por:
Ahora bien, si las condiciones (por ejemplo, pH) son tales que aparecen en la solución otras especies de carbonato (o de calcio), (por ejemplo, ión bicarbonato, HCO3-), entonces la solubilidad del sólido aumentará aunque el producto de solubilidad se mantiene constante.
Del mismo modo, si un agente complejante, por ejemplo, EDTA, está presente en la solución, la solubilidad aumentará debido a la formación de complejos de calcio (un complejo tiene una identidad química diferente que el ión Ca2+ no complejado y por lo tanto no interviene en el equilibrio de solubilidad).
Para predecir correctamente la solubilidad de un determinado producto soluble, es necesario conocer la especiación (o evaluada, al menos aproximadamente). El hecho de no hacerlo es un problema común y puede conducir a grandes errores.
Efectro de fase
Los equilibrios se definen para fases cristalinas específicas. Por lo tanto, el producto de solubilidad se espera que sea diferente en función de la fase del sólido. Por ejemplo, la aragonita y la calcita tendrán diferentes productos de solubilidad a pesar de que ambos tienen la misma identidad química (carbonato de calcio). Sin embargo, en determinadas condiciones, lo más probable es que sólo una fase sea termodinámicamente estables y por lo tanto esta fase entra en un verdadero equilibrio.
Efecto del tamaño de partícula
La constante termodinámica de solubilidad se define para monocristales grandes. La solubilidad aumenta con el tamaño decreciente de las partículas de soluto (o gotitas) debido a la energía adicional de superficie. Este efecto es generalmente pequeño a menos que las partículas sean muy pequeñas, generalmente menores de 1 μm. El efecto del tamaño de partícula en la constante de solubilidad constante se puede cuantificar como sigue:
dónde * KA es la constante de solubilidad de las partículas de soluto con un área superficial molar A,
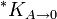 es la constante de solubilidad de la sustancia cuando el área superficial molar tiende a cero (es decir, cuando las partículas son grandes), γ es la tensión superficial de las partículas del soluto en el disolvente, Am es el área superficial molar del soluto (en m2/mol), R es la constante universal de los gases ideales, y T es la temperatura absoluta[2] .
es la constante de solubilidad de la sustancia cuando el área superficial molar tiende a cero (es decir, cuando las partículas son grandes), γ es la tensión superficial de las partículas del soluto en el disolvente, Am es el área superficial molar del soluto (en m2/mol), R es la constante universal de los gases ideales, y T es la temperatura absoluta[2] .Efectos de temperatura
La solubilidad es sensible a los cambios en la temperatura. Por ejemplo, el azúcar es más soluble en agua caliente que en agua fría. Esto ocurre debido a que las constantes de solubilidad, como otros tipos de constante de equilibrio, son función de la temperatura. De acuerdo con el Principio de Le Chatelier, cuando el proceso de disolución es endotérmico (se absorbe calor), la solubilidad aumenta con la temperatura, pero cuando el proceso es exotérmico (se libera calor) solubilidad disminuye con la temperatura.[3] Sin embargo, dado que cuando un sólido se disuelve hay un cambio favorable de entropía, muchos sólidos serán más solubles con el aumento de la temperatura, independientemente del principio de Le Chatelier. La ecuación de la Energía libre de Gibbs expresa la visión global de este problema.
Constantes de solubilidad
Las constantes de solubilidad se han determinado experimentalmente para un gran número de compuestos y las tablas están disponibles fácilmente. Para los compuestos iónicos las constantes se llaman "productos de solubilidad". Las unidades de concentración se supone que son molar a menos que se indique lo contrario. La solubilidad suele aparecer en unidades de gramos (disueltos) por litro de agua.
Algunos valores[4] a 25°C:
- Carbonato de bario: 2.60×10−9
- Cloruro de cobre (I): 1.72×10−7
- Sulfato de plomo (II): 1.81×10−8
- Carbonato de magnesio: 1.15×10−5
- Cloruro de plata: 1.70×10−10
- Bromuro de plata: 7.7×10−13
- Hidróxido de calcio: 8.0×10−6
See also
Tabla
Tabla de productos de solubilidad Compuesto Fórmula Temperatura Ksp Fuente
(legenda más abajo)Hidróxido de aluminio anhidro Al(OH)3 20°C 1.9×10–33 L Hidróxido de aluminio anhidro Al(OH)3 25°C 3×10–34 w1 Hidróxido de aluminio trihidrato Al(OH)3.3H2O 20°C 4×10–13 C Hidróxido de aluminio trihidrato Al(OH)3.3H2O 25°C 3.7×10–13 C Fosfato de aluminio AlPO4 25°C 9.84×10–21 w1 Bromato de bario Ba(BrO3)2 25°C 2.43×10–4 w1 Carbonato de bario BaCO3 16°C 7×10–9 C, L Carbonato de bario BaCO3 25°C 8.1×10–9 C, L Cromato de bario BaCrO4 28°C 2.4×10–10 C, L Fluoruro de bario BaF2 25.8°C 1.73×10–6 C, L Iodato de bario dihidrato Ba(IO3)2.2H2O 25°C 6.5×10–10 C, L Oxalato de bario dihidrato BaC2O4.2H2O 18°C 1.2×10–7 C, L Sulfato de bario BaSO4 18°C 0.87×10–10 C, L Sulfato de bario BaSO4 25°C 1.08×10–10 C, L Sulfato de bario BaSO4 50°C 1.98×10–10 C, L Hidróxido de berilio Be(OH)2 25°C 6.92×10–22 w1 Carbonato de cadmio CdCO3 25°C 1.0×10–12 w1 Hidróxido de cadmio Cd(OH)2 25°C 7.2×10–15 w1 Oxalato de cadmio trihidrato CdC2O4.3H2O 18°C 1.53×10–8 C, L Fosfato de cadmio Cd3(PO4)2 25°C 2.53×10–33 w1 Sulfuro de cadmio CdS 18°C 3.6×10–29 C, L Carbonato de calcio calcita CaCO3 15°C 0.99×10–8 C, L Carbonato de calcio calcita CaCO3 25°C 0.87×10–8 C, L Carbonato de calcio calcita CaCO3 18-25°C 4.8×10–9 P Cromato de calcio CaCrO4 18°C 2.3×10–2 L Fluoruro de calcio CaF2 18°C 3.4×10–11 C, L Fluoruro de calcio CaF2 25°C 3.95×10–11 C, L Hidróxido de calcio Ca(OH)2 18°C-25°C 8×10–6 P Hidróxido de calcio Ca(OH)2 25°C 5.02×10–6 w1 Iodato de calcio hexahidrato Ca(IO3)2.6H2O 18°C 6.44×10–7 L Oxalato de calcio monohidrato CaC2O4 18°C 1.78×10–9 C, L Oxalato de calcio monohidrato CaC2O4 25°C 2.57×10–9 C, L Fosfato de calcio Ca3(PO4)2 25°C 2.07×10–33 w1 Sulfato de calcio CaSO4 10°C 6.1×10–5 C, L Sulfato de calcio CaSO4 25°C 4.93×10–5 w1 Tartrato de calcio dihidrato CaC4H4O6.2H2O 18°C 7.7×10–7 C, L Hidróxido de cromo (II) Cr(OH)2 25°C 2×10–16 w2 Hidróxido de cromo (III) Cr(OH)3 25°C 6.3×10–31 w2 Hidróxido de cobalto (II) Co(OH)2 25°C 1.6×10–15 w2 Sulfuro de cobalto (en la forma menos soluble) CoS 18°C 3×10–26 C, L Sulfuro de cobalto (en la forma más soluble) CoS 18°C-25°C 10–21 P Carbonato de cobre CuCO3 25°C 1×10–10 P Hidróxido de cobre (II) Cu(OH)2 18°C-25°C 6×10–20 P Hidróxido de cobre (II) Cu(OH)2 25°C 4.8×10–20 w1 Iodato de cobre (II) Cu(IO3)2 25°C 1.4×10–7 C, L Oxalato de cobre (II) CuC2O4 25°C 2.87×10–8 C, L Sulfuro de cobre (II) CuS 18°C 8.5×10–45 C, L Bromuro de cobre (I) CuBr 18°C-20°C 4.15×10–8 C Cloruro de cobre (I) CuCl 18°C-20°C 1.02×10–6 C Hidróxido de cobre (I)
(en equilib. con Cu2O + H2O)Cu(OH) 25°C 2×10–15 w1 Ioduro de cobre (I) CuI 18°C-20°C 5.06×10–12 C Sulfuro de cobre (I) Cu2S 16°C-18°C 2×10–47 C, L Tiocianato de cobre (I) CuSCN 18°C 1.64×10–11 C, L Hidróxido de hierro (III) Fe(OH)3 18°C 1.1×10–36 C, L Carbonato de hierro (II) FeCO3 18°C-25°C 2×10–11 P Hidróxido de hierro (II) Fe(OH)2 18°C 1.64×10–14 C, L Hidróxido de hierro (II) Fe(OH)2 25°C 1×10–15; 8.0×10–16 P; w2 Oxalato de hierro (II) FeC2O4 25°C 2.1×10–7 C, L Sulfuro de hierro (II) FeS 18°C 3.7×10–19 C, L Bromuro de plomo (II) PbBr2 25°C 6.3×10–6; 6.60×10–6 P; w1 Carbonato de plomo (II) PbCO3 18°C 3.3×10–14 C, L Cromato de plomo (II) PbCrO4 18°C 1.77×10–14 C, L Cloruro de plomo (II) PbCl2 25.2°C 1.0×10–4 L Cloruro de plomo (II) PbCl2 18°C-25°C 1.7×10–5 P Fluoruro de plomo (II) PbF2 18°C 3.2×10–8 C, L Fluoruro de plomo (II) PbF2 26.6°C 3.7×10–8 C, L Hidróxido de plomo (II) Pb(OH)2 25°C 1×10–16; 1.43×10–20 P; w1 Iodato de plomo (II) Pb(IO3)2 18°C 1.2×10–13 C, L Iodato de plomo (II) Pb(IO3)2 25.8°C 2.6×10–13 C, L Ioduro de plomo (II) PbI2 15°C 7.47×10–9 C Ioduro de plomo (II) PbI2 25°C 1.39×10–8 C Oxalato de plomo (II) PbC2O4 18°C 2.74×10–11 C, L Sulfato de plomo (II) PbSO4 18°C 1.6×10–8 C, L Sulfuro de plomo (II) PbS 18°C 3.4×10–28 C, L Carbonato de litio Li2CO3 25°C 1.7×10–3 C, L Fluoruro de litio LiF 25°C 1.84×10–3 w1 Fosfato de litio Li3PO4 25° 2.37×10–4 w1 Fosfato de amonio y magnesio MgNH4PO4 25°C 2.5×10–13 C, L Carbonato de magnesio MgCO3 12°C 2.6×10–5 C, L Fluoruro de magnesio MgF2 18°C 7.1×10–9 C, L Fluoruro de magnesio MgF2 25°C 6.4×10–9 C, L Hidróxido de magnesio Mg(OH)2 18°C 1.2×10–11 C, L Oxalato de magnesio MgC2O4 18°C 8.57×10–5 C, L Carbonato de manganeso (II) MnCO3 18°C-25°C 9×10–11 P Hidróxido de manganeso (II) Mn(OH)2 18°C 4×10–14 C, L Sulfuro de manganeso (rosa) MnS 18°C 1.4×10–15 C, L Sulfuro de manganeso (verde) MnS 25°C 10–22 P Bromuro de mercurio (II) HgBr2 25°C 8×10–20 L Cloruro de mercurio (II) HgCl2 25°C 2.6×10–15 L Hidróxido de mercurio (II)
(en equilib. con HgO + H2O)Hg(OH)2 25°C 3.6×10–26 w1 Ioduro de mercurio (II) HgI2 25°C 3.2×10–29 L Sulfuro de mercurio (II) HgS 18°C 4×10–53 to 2×10–49 C, L Bromuro de mercurio (I) HgBr 25°C 1.3×10–21 C, L Cloruro de mercurio (I) Hg2Cl2 25°C 2×10–18 C, L Ioduro de mercurio (I) HgI 25°C 1.2×10–28 C, L Sulfato de mercurio (I) Hg2SO4 25°C 6×10–7; 6.5×10–7 P; w1 Hidróxido de níquel (II) Ni(OH)2 25°C 5.48×10–16 w1 Sulfuro de níquel (II) NiS 18°C 1.4×10–24 C, L Sulfuro de níquel (II) (en la forma menos soluble) NiS 18°C-25°C 10–27 P Sulfuro de níquel (II) (en la forma más soluble) NiS 18°C-25°C 10–21 P tartrato ácido de potasio KHC4H4O6 18°C 3.8×10–4 C, L Perclorato de potasio KClO4 25°C 1.05×10–2 w1 Periodato de potasio KIO4 25° 3.71×10–4 w1 Acetato de plata AgC2H3O2 16°C 1.82×10–3 L Bromato de plata AgBrO3 20°C 3.97×10–5 C, L Bromato de plata AgBrO3 25°C 5.77×10–5 C, L Bromuro de plata AgBr 18°C 4.1×10–13 C, L Bromuro de plata AgBr 25°C 7.7×10–13 C, L Carbonato de plata Ag2CO3 25°C 6.15×10–12 C, L Cloruro de plata AgCl 4.7°C 0.21×10–10 C, L Cloruro de plata AgCl 9.7°C 0.37×10–10 L Cloruro de plata AgCl 25°C 1.56×10–10 C, L Cloruro de plata AgCl 50°C 13.2×10–10 C, L Cloruro de plata AgCl 100°C 21.5×10–10 C, L Cromato de plata Ag2CrO4 14.8°C 1.2×10–12 C, L Cromato de plata Ag2CrO4 25°C 9×10–12 C, L Cianuro de plata Ag2(CN)2 20°C 2.2×10–12 C, L Dicromato de plata Ag2Cr2O7 25°C 2×10–7 L Hidróxido de plata AgOH 20°C 1.52×10–8 C, L Iodato de plata AgIO3 9.4°C 0.92×10–8 C, L Ioduro de plata AgI 13°C 0.32×10–16 C, L Ioduro de plata AgI 25°C 1.5×10–16 C, L Nitrito de plata AgNO2 25°C 5.86×10–4 L Oxalato de plata Ag2C2O4 25°C 1.3×10–11 L Sulfato de plata Ag2SO4 18°C-25°C 1.2×10–5 P Sulfuro de plata Ag2S 18°C 1.6×10–49 C, L Tiocianato de plata AgSCN 18°C 0.49×10–12 C, L Tiocianato de plata AgSCN 25°C 1.16×10–12 C, L Carbonato de estroncio SrCO3 25°C 1.6×10–9 C, L Cromato de estroncio SrCrO4 18°C-25°C 3.6×10–5 P Fluoruro de estroncio SrF2 18°C 2.8×10–9 C, L Oxalato de estroncio SrC2O4 18°C 5.61×10–8 C, L Sulfato de estroncio SrSO4 2.9°C 2.77×10–7 C, L Sulfato de estroncio SrSO4 17.4°C 2.81×10–7 C, L Bromuro de talio (I) TlBr 25°C 4×10–6 L Cloruro de talio (I) TlCl 25°C 2.65×10–4 L Sulfato de talio (I) Tl2SO4 25°C 3.6×10–4 L Tiocianato de talio (I) TlSCN 25°C; 2.25×10–4 L Hidróxido de estaño (II) Sn(OH)2 18°C-25°C 1×10–26 P Hidróxido de estaño (II) Sn(OH)2 25°C 5.45×10–27; 1.4×10–28 w1; w2 Sulfuro de estaño (II) SnS 25°C 10–28 P Hidróxido de cinc Zn(OH)2 18°C-20°C 1.8×10–14 C, L Oxalato de cinc dihidrato ZnC2O4.2H2O 18°C 1.35×10–9 C, L Sulfuro de cinc ZnS 18°C 1.2×10–23 C, L Fuente legenda: L=Lange's 10th ed.; C=CRC 44th ed.; P=General Chemistry by Pauling, 1970 ed.; w1=Web source 1; w2=Web source 2 Referencias
- ↑ J. Mendham, R.C. Denney, J.D. Barnes and M. Thomas (ed.). Vogel's Quantitative Chemical Analysis, 6th edition. ISBN 0-582 22628 7.
- ↑ Hefter, G.T., Tomkins, R.P.T. (editors), "The Experimental Determination of Solubilities", John Wiley and Sons, Ltd., 2003.
- ↑ Pauling, Linus: General Chemistry, Dover Publishing, 1970, p 450
- ↑ H.P.R. Frederikse, David R. Lide (ed.). CRC Handbook of Chemistry and Physics. ISBN 0-8493-0478-4.
Enlaces
- UC Berkeley video lecture on solubility equilibria
Plantilla:Chemical solutions Equilibrio de solubilidad
Categorías: Equilibrium chemistry | Solutions
Wikimedia foundation. 2010.

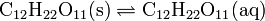
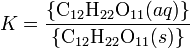
![K_s = \left[\mathrm{{C}_{12}{H}_{22}{O}_{11}}(aq)\right]\,](/pictures/eswiki/49/1bf337b3d2df2d123234dd50f9b7e37e.png)
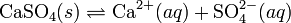
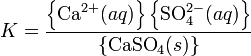
![K_{\mathrm{sp}} = \left[\mbox{Ca}^{2+}(aq)\right]\left[\mbox{SO}_4^{2-}(aq)\right].\,](/pictures/eswiki/57/9f9d19ff487322a888ed709ef071964b.png)
![\sqrt{ K_{\mathrm{sp}}}=\sqrt{4.93\times10^{-5}}=7.02\times10^{-3}=\left[\mbox{Ca}^{2+}\right]=\left[\mbox{SO}_4^{2-}\right].\,](/pictures/eswiki/100/d8f27e2d8b1b3d025aebb0ae3e34a77b.png)
![K_{\mathrm{sp}} = \left[\mbox{Ca}^{2+}(aq)\right]\left[\mbox{OH}^{-}(aq)\right]^2 = \left[\mbox{Ca}^{2+}(aq)\right](2\left[\mbox{Ca}^{2+}(aq)\right])^2.\,](/pictures/eswiki/51/3eac0374207dce0d33394743f2c1c0ec.png)
![K_{\mathrm{sp}} = x(2x)^2 = 4x^3 \therefore x = \sqrt[3]{\frac{K_{\mathrm{sp}}}{4}}\,](/pictures/eswiki/101/e912ea409777b26adec23c9c2da050da.png)
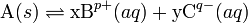
![\sqrt[n]{K_{\mathrm{sp}} \over {x^x \cdot y^y}} = {C \over M_M}](/pictures/eswiki/54/62fc927caa8562a42403ccdd8d964d21.png)
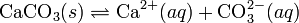
![K_{\mathrm{sp}} = \left[\mbox{Ca}^{2+}(aq)\right]\left[\mbox{CO}_3^{2-}(aq)\right].\,](/pictures/eswiki/49/17d69cb95017f05341499620afa9aec0.png)