- Superfamilia de las inmunoglobulinas
-
La superfamilia de las inmunoglobulinas (IgSF) es un extenso grupo de proteínas solubles y de superficie celular que están implicadas en procesos de reconocimiento, unión o adhesión celular de las células. La asignación de una molécula a esta superfamilia se basa en que comparten rasgos estructurales con las inmunoglobulinas (también conocidas como anticuerpos). Todas ellas poseen un dominio conocido como dominio o plegamiento inmunoglobulina. Entre los miembros de la IgSF se incluyen receptores de antígenos en la superficie celular, correceptores y moléculas de coestimulación del sistema inmunitario, moléculas imlplicadas en la presentación de antígeno a los linfocitos, moléculas de adhesión celular y ciertos receptores de citocinas. Habitualmente están asociadas con funciones del sistema inmunitario.
Contenido
Dominio inmunoglobulina
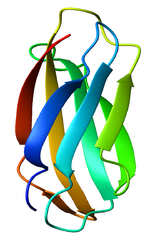
El criterio de clasificación de esta superfamilia es que posean un dominio estructural conocido como Plegamiento de inmunoglobunina (dominio Ig). Los dominios Ig reciben su nombre de las moléculas de inmunoglobulina, en donde fueron descubiertos por primera vez. Constan de entre 70-110 aminoácidos y se clasifican en diferentes tipos de acuerdo a su tamaño y función.[1] Los dominios Ig poseen un plegamiento Ig característico que es una estructura en forma de "sándwich" formada por dos láminas β antiparalelas. Las interacciones entre los aminoácidos cargados en la cara interna del sándwich y los enlaces disulfuro formados entre residuos de cisteína que están conservados en casi todos los dominios Ig y que estabilizan los plieges Ig. Un extremo del dominio Ig alberga la sección llamada región determinante de la complementariedad que es importante para la especificidad de los miembros de la superfamilia para sus ligandos. Los tipos más importantes de dominio Ig son los dominios variables (IgV) y los constantes (o IgC). Los dominios IgV son generalmente más largos (con 9 cadenas beta) que los dominios IgC (7 cadenas beta). No obstante, hay algunos dominios Ig que entran dentro de categorías distintas. Los dominios Ig de algunos miembros de la superfamilia recuerdan a los dominios IgV en su composición de aminoácidos, aunque sean similares en tamaño a los dominios IgC. Se llaman dominios IgC2, mientras que los dominios IgC habituales se llaman IgC1. Existen otros dominios Ig que reciben el nombre de dominios intermedios o dominios IgI.
Miembros de la superfamilia de las inmunoglobulinas
Miembros de la superfamilia de las inmunoglobulinas Molécula: función/categoría Ejemplos Receptores de antígeno - Anticuerpos o inmunoglobulinas
- Cadenas del Receptor de linfocitos T.
Moléculas presentadoras de antígeno - Clase I MHC
- Class II MHC
- beta-2 microglobulina
Co-receptores Moléculas accesorias de receptores de antígeno - CD3 cadenas -γ, -δ y -ε
- CD79a y CD79b
Moléculas co-estimuladoras o inhibidoras Receptores de célula asesina natural - KIRs (receptores de NK semejantes a inmunoglobulina)
Moléculas de adhesión Receptores de citoquinas y factores de crecimientoCytokine and growth factor receptors - receptor de la Interleucina-1 tipo I
- Precursor d del receptor de la interleucina-1 tipo II (IL-1R-2, IL-1R-beta, antígeno CD121b)
- Receptor del factor de crecimiento derivado de plaquetas (PDGFR)
- precursor de la cadena alfa del receptor de la interleucina-6 (IL-6R-alpha, antígeno CD126)
- Precursor del receptor del Factor estimulador de colonias de macrófagos-1 (CSF-1-R, antígeno CD115)
- Precursor del receptor del factor de crecimiento de las células madre de las células cebadas. (SCFR, c-kit, antígeno CD117).
- Precursor básico del receptor del factor de crecimiento de fibroblastos-1 (FGFR-1, receptor tirosín quinasa CEK1)
Receptores tirosín-quinasa/fosfatasas - Precursor Tie-1 del receptor tirosín-kinasa
- Precursor mu de latirosín-proteín fosfatasa semejante a receptores.
Receptores de unión a Ig - receptor polimérico de inmunoglobulina (PIGR)
- Algunos receptores de Fc
Otras - CD147
- Antígeno de diferenciación de los timocitos-1 (Thy-1), también conocido como CD90
- CD7
- Butirofilinas
- Precursor de la subunidad beta-1 del Canal de sodio
Anotadores de antígeno y ligandos
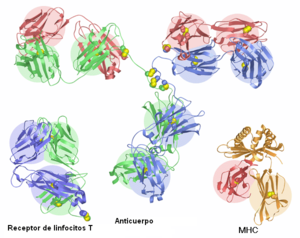
Los receptores de antígeno que se encuentran en la superficie de los linfocitos T y B en todos los vertebrados con mandíbulas pertenecen a la superfamilia de las inmunoglobulinas. Las moléculas de inmunoglobulina (los receptores de antígeno de los linfocitos B) son los "miembros fundadores" de la superfamilia, en el sentido de que originaron la clasificación. En humanos existen cinco tipos distintos de moléculas de inmunoglobulina, los cuales contienen todos una cadena pesada con cuatro dominios Ig y una cadena ligera con dos dominios Ig. El receptor de antígeno de los linfocitos T es el receptor de linfocitos T (TCR), que está compuesto por dos cadenas, que pueden ser o bien la TCR-alfa y la TCR-beta, o bien la TCR-delta y la TCR-gamma. Todas estas cadenas TCR contienen dos dominios Ig en su porción extracelular, un dominio IgV en el extremo N-terminal y un dominio IgC1 adyacente a la membrana celular. Los ligandos de las TCRS son proteínas del complejo mayor de histocompatibilidad Estas se presentan en dos formas: La clase MHC forma un dímero con una molécula llamada beta-2 microglobulina (β2M) e interactúa con el TCR en linfocitos T citotóxicos y las proteínas del MHC clase II tiene dos cadenas (alfa y beta) que interactúan con el TCR en los linfocitos T colaboradores. Las MHC case I y II y las moléculas poseen dominios Ig y por tanto son miembros de la superfamilia de las inmunoglobulinas.
Co-receptores y moléculas accesorias
Otras moléculas de la superficie de los linfocitos T interactúan también con las moléculas del del MHC durante el reconocimiento del TCR. Son conocidas como correceptores. En las poblaciones de linfocitos, el correceptor CD4 se encuentra en los linfocitos T colaboradores y el correceptor CD8 se encuentra en los linfocitos T citotóxicos. El CD4 tiene cuatro dominios Ig en su porción extracelular y funciona como un monómero. El CD8, por el contrario, funciona como un dímero que posee o bien dos cadenas alfa idénticas, o más normalmente, con una cadena alfa y otra beta. ambas cadenas alfa y beta poseen cada una un dominio IgV en su porción extracelular. Se encuentra también una molécula más en la superficie de los linfocitos T que también está implicada en la señalización por el TCR, el receptor CD3. Ésta es una molécula que ayuda a trasmitir una señal a partir del TCR después de su interacción con las moléculas del CMH. En humanos el CD3 está compuesto por tres cadenas diferentes, la cadena gamma, la delta y la épsilon, todas las cuales son moléculas de la superfamilia de las inmunoglobulinas con un único dominio Ig.
De modo similar a lo que sucede en los linfocitos T, los linfocitos B también poseen correceptores de superficie y moléculas accesorias que asisten en la activación de la inmununoglobulina del receptor de los linfocitos B (BCR). Se utilizan dos cadenas en la señalización, CD79a y CD79b que poseen un único dominio Ig. El BCR también utiliza un complejo de correcepción, que contiene a CD19, una molécula de la familia de las inmunoglobulinas con dos dominios IgC2.
Moléculas coestimuladoras o inhibidoras
Los receptores y ligandos coestimuladores e inhibidores de señalización controlan las funciones efectoras y de expansión de las células. Un grupo importantes de receptores coestimuladores de la superfamilia de las imunoglobulinas son las moléculas de la familia CD28: CD28, CTLA-4, program death-1 (muerte programada-1 o PD-1), El atenuador de los linfocitos B y T (BTLA, CD272), and the inducible T-cell co-stimulator (ICOS, CD278);[2] y sus ligandos de la superfamilia de las inmunoglobulinas pertenecen a la familia B7: CD80 (B7-1), CD86 (B7-2), Ligando ICOS, PD-L1 (B7-H1), PD-L2 (B7-DC), B7-H3 y B7-H4 (B7x/B7-S1).[3]
El CD28 se expresa en los linfocitos T y se puede unir a los ligandos CD80 (B7-1) o CD86 (B7-2) que se expresan en las células presentadoras de antígenos "profesionales", como las células dendríticas, macrófagos y linfocitos B activados.[4] Estos mismos dos ligandos son compartidos por el receptor CTLA-4 que inhibe las respuestas de los linfocitos T dependientes de CD28 y son también miembros de la superfamilia de las inmunoglobulinas.[5] El CTLA-4 se expresa en la superficie de los linfocitos T activados.[2]
El PD-1 se encuentra en los linfocitos T activados, en los B y en monocitos, y así mismo con mucha menor expresion en las células asesinas naturales, poseyendo también dos ligandos de la familia B7, el PD-L1 y el PD-L2. PD-L1 se expresa en los linfocitos B y T, en las células mieloides, las células dendríticas y las células endoteliales. También se pueden encontrar en algunos órganos no linfoides como el pulmón, el corazón, el músculo, el páncreas y la placenta.[6]
ICOS está presente en los linfocitos T y puede sobrerregularse tras la activación del TCR y el CD28. También se expresa en las células asesinas naturales activadas. El único ligando de ICOS es el ligando de ICOS (ICOSL) que se encuentra en los linfocitos B, macrófagos, células dendríticas, algunos linfocitos T y en algunas células endoteliales y epiteliales.[7]
Referencias
- ↑ Barclay A (2003). «Membrane proteins with immunoglobulin-like domains--a master superfamily of interaction molecules». Semin Immunol 15 (4): pp. 215–23. doi:. PMID 14690046.
- ↑ a b Peggs K, Allison J (2005). «Co-stimulatory pathways in lymphocyte regulation: the immunoglobulin superfamily». Br J Haematol 130 (6): pp. 809–24. doi:. PMID 16156851.
- ↑ Greenwald R, Freeman G, Sharpe A. «The B7 family revisited». Annu Rev Immunol 23: pp. 515–48. doi:. PMID 15771580.
- ↑ Borriello F, Sethna MP, Boyd SD, Schweitzer AN, Tivol EA, Jacoby D, Strom TB, Simpson EM, Freeman GJ, Sharpe AH (1997). «B7-1 and B7-2 have overlapping, critical roles in immunoglobulin class switching and germinal center formation». Immunity 6 (3): pp. 303–13. doi:. PMID 16156851.
- ↑ Bhatia S, Edidin M, Almo S, Nathenson S (2006). «B7-1 and B7-2: similar costimulatory ligands with different biochemical, oligomeric and signaling properties». Immunol Lett 104 (1-2): pp. 70–5. doi:. PMID 16413062.
- ↑ Greenwald R, Freeman G, Sharpe A (2005). «The B7 family revisited». Annu Rev Immunol 23: pp. 515–48. doi:. PMID 15771580.
- ↑ Nurieva RI, Mai XM, Forbush K, Bevan MJ, Dong C (2003). «B7h is required for T cell activation, differentiation, and effector function». Proc Natl Acad Sci U S A 100 (24): pp. 14163–8. doi:. PMID 14615582.
Enlaces externos
Categoría:- Inmunoglobulinas
Wikimedia foundation. 2010.