- Propano
-
Propano
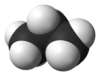
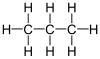
Nombre (IUPAC) sistemático Propano General Fórmula semidesarrollada CH3CH2CH3 Fórmula molecular C3H8 Identificadores Número CAS 74-98-6 PubChem Propiedades físicas Estado de agregación Gas Apariencia Incoloro Densidad 1.83 kg/m3; 0,00183 g/cm3 Masa molar 44 g/mol Punto de fusión 85,5 K (-187,65 °C) Punto de ebullición 231.05 K (-42.1 °C) Temperatura crítica 367.15 K ( °C) Viscosidad 0.2 cP (-40 ºC) Índice de refracción 1.3407 (-42 ºC) Propiedades químicas Solubilidad en agua 80 mg/l a 20 °C Momento dipolar 0.08 D Compuestos relacionados Alcanos Butano, Pentano, Metilpropano Termoquímica ΔfH0gas -104.7±0.50 kJ/mol ΔfH0líquido -119.8 ± 0.59 kJ/mol S0líquido, 1 bar 171.0 J·mol-1·K-1 Peligrosidad Punto de inflamabilidad 169,15 K (-103,85 °C) NFPA 704 Temperatura de autoignición 813,1 K (540,1 °C) Frases R R12 Frases S S2, S9, S16, Riesgos Inhalación Somnolencia y pérdida del conocimiento. Llevar al accidentado inmediatamente a un sitio al aire libre y mantenerlo en reposo. Respiración artificial si éste estuviese indicado. Proporcionar asistencia médica Piel En contacto con líquido: congelación. En caso de congelación, aclarar con abundante agua. No se debe quitar la ropa. Proporcionar asistencia médica Ojos En contacto con líquido: congelación. En caso de congelación, enjuagar con abundante agua por varios minutos. Proporcionar asistencia médica Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl propano (del griego pro primer orden y pion grasa, y el sufijo químico -ano dado que es el primero en los ácidos grasos) es un gas incoloro e inodoro. Pertenece a los hidrocarburos alifáticos con enlaces simples de carbono, conocidos como alcanos. Su fórmula química es C3H8:
Contenido
Generales
Las mezclas de propano con el aire pueden ser explosivas con concentraciones del 1,8 al 9,3 % Vol de propano. La llama del propano, al igual que la de los demás gases combustibles, debe de ser completamente azul; cualquier parte amarillenta, anaranjada o rojiza de la misma, denota una mala combustión. A temperatura ambiente, es inerte frente a la mayor parte de los reactivos aunque reacciona por ejemplo con el bromo en presencia de luz. En elevadas concentraciones el propano tiene propiedades narcotizantes.
Historia
El propano se identificó como componente volátil en la gasolina por el Dr. Walter O. Snelling de la oficina de minas de EE.UU. en 1910. Debido a la volatilidad de estos hidrocarburos ligeros, fueron conocidos como "salvajes" ("wild" en inglés) por la gran presión de vapor en la gasolina no refinada. El 31 de Marzo, el New York Times informó sobre el trabajo con gas licuado del Dr. Snelling y que "... una botella de acero de este gas será suficiente para alumbrar un hogar común durante tres semanas."[1]
Tensión de vapor
Tensión de vapor del propano en función de la temperatura:
Temperatura Presión 80 °C 18 kg/cm² 40 °C 13,125 kg/cm2 30 °C 11,250 kg/cm2 15 °C 7,500 kg/cm2 0 °C 5,000 kg/cm2 -10 °C 3,800 kg/cm2 -20 °C 2,750 kg/cm2 -30 °C 1,880 kg/cm² -40 °C 1,250 kg/cm2 Síntesis
El propano se suele obtener del gas natural o de los gases de los procesos de "cracking" producidos en las instalaciones petroquímicas.
Usos
El principal uso del propano es el aprovechamiento energético como combustible. Con base al punto de ebullición más bajo que el butano y el mayor valor energético por gramo, a veces se mezcla con éste o se utiliza propano en vez de butano. En la industria química es uno de los productos de partida en la síntesis del propeno. Además se utiliza como gas refrigerante (R290) o como gas propulsor en aerosoles.
Véase también
Enlaces externos
 Wikimedia Commons alberga contenido multimedia sobre PropanoCommons.
Wikimedia Commons alberga contenido multimedia sobre PropanoCommons.- Instituto nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del propano.
Referencias
- ↑ The New York Times: p. 9. 1 de abril de 1912. http://query.nytimes.com/gst/abstract.html?res=9C04E3DB1F31E233A25752C0A9629C946396D6CF. Consultado el 22-12-2007.
Wikimedia foundation. 2010.