- Sindecán-4
-
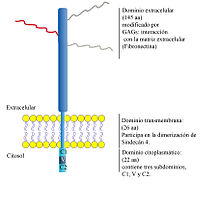
Sindecán-4 (SDC4, Syn4, Sin4) es un proteoglicán de heparán sulfato de transmembrana, que pertenece a la familia de los sindecanes (del griego, Syndein: que une), proteoglicanes de superficie celular, los cuales poseen un dominio de transmembrana y un ectodominio, al cual se unen covalentemente tres cadenas de glicosaminoglicanes (GAGs). SDC4 posee un pequeño dominio intracelular, el cual está dividido en tres regiones conservadas a lo largo de la evolución; la región proximal a la membrana (C1), la región distal (C2) y la región variable (V), particular de cada Sindecán.
Contenido
- 1 Funciones y características
- 2 Modificaciones postraduccionales de SDC4
- 3 Interacciones
- 4 Referencias
Funciones y características
Función y señalización de SDC4 en la adhesión celular
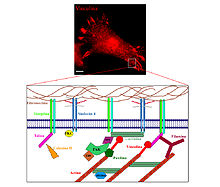
SDC4 fue identificado inicialmente como una molécula capaz de mediar la interacción entre la matriz extracelular (MEC) y la célula. La MEC corresponde a una compleja red extracelular, compuesta por diversas moléculas (como laminina, fibronectina (FN), Colágeno y proteoglicanes). Esta interacción, está mediada por estructuras llamadas focos de adhesión (FA), uniones especializadas que permiten la adhesión celular y regulan su migración. Los FA se componen de receptores de superficie como integrinas o sindecanes y moléculas intracelulares, como vinculina, Paxillin paxilina y talina. Los FA regulan la arquitectura y movimiento celular mediante su contacto con el citoesqueleto de actina.
En 1994 el grupo de John Couchman, utilizando un anticuerpo específico para el dominio citoplasmático de SDC4, demostró su localización en los FA, mediante su colocalización con el marcador vinculina, en varios tipos celulares en cultivo. Demostraron también que la presencia de SDC4 es necesaria para la localización específica de vinculina en tales estructuras celulares.[1] Posteriormente, se demostró que FN, se une a las cadenas de glicosaminoglicanes de SDC4, mediante sitios de unión a heparina (HepII), presentes en su dominio carboxilo terminal.[2] De esta forma se definió a SDC4 en conjunto a integrinas, como un ancla entre la célula y la MEC La unión de FN a SDC4 induce una cascada de señalización mediada por la vía del fosfatidil inositol 4,5 bifosfato (PIP2), proteína quinasa Cα (PKCα) y RhoA, promoviendo la formación de los FA y fibras de estrés.[3] SDC4 une a PIP2 lo cual estabiliza la oligomerización de SDC4, promoviendo la unión de SDC4 a PKCα y su activación.[4] [5] [6] La unión de SDC4 a PIP2 resulta en la localización de PKCα en los FA, PKCα, participa en la última etapa del ensamblaje del FA. El paso final de esta cascada es la activación de la GTPasa RhoA, la cual regula la formación de las fibras de estrés.
En 1999, Saoncella y colaboradores demostraron que SDC4 es necesario para el ensamble de los FA. En dicho trabajo se evaluó la adhesión de fibroblastos de ratón knockout para FN. Cuando se agregan a placas conteniendo FN exógena sin los sitios HepII, sólo se logra la adhesión de los fibroblastos, cuando además se adiciona un anticuerpo para SDC4 como sustrato, demostrándose que el anclaje de SDC4 a FN es esencial para la formación de los FA.[7]
Función de SDC4 en la migración celular
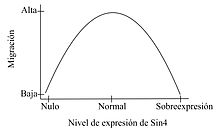
La migración celular es un proceso altamente dinámico que es esencial para diversos procesos en un organismo, como la morfogénesis, cierre de heridas, metástasis de células cancerosas y la respuesta inmune.[8] Una célula en migración requiere de la formación de filamentos de actina en el frente de migración, la cual va a generar la fuerza necesaria para el movimiento de la célula. Se necesita también, la formación de FA, con la participación de moléculas de adhesión en el frente de migración y el desensamblaje de dichas adhesiones en la zona distal al movimiento, de forma de permitir su avance direccional. Longley y colaboradores en 1999, demostraron que SDC4 regula la migración, morfología y citoesqueleto de células CHO, ya que una sobreexpresión de SDC4 en dichas células, genera una mayor cantidad y tamaño de los FA, como también disminuye la organización de las fibras de estrés y la capacidad de dichas células de migrar hacia un quimioatractante.[9] Posteriormente Bass y colaboradores demostraron que SDC4 puede regular la migración direccional de fibroblastos, mediada por la MEC. En fibroblastos silvestres, Rac1 está localizada, sin embargo fibroblastos nulos para SDC4, migran al azar y no polarizan Rac1. Dicho fenotipo puede ser rescatado por SDC4 silvestre; sin embargo, no hay rescate cuando se expresa un SDC4 que no une a PKC.[10] De dichos trabajos se deduce que tanto una ganancia como una pérdida de función de SDC4, afectan la correcta migración celular, indicando que se requiere de niveles precisos de SDC4, para una migración celular adecuada.
Función de SDC4 en la migración de células tumorales
La invasividad o infiltración de las células cancerosas, consiste en su expansión y migración desde la capa de tejido en que se desarrolla, a territorios sanos que rodean a dicho tejido y constituye una de las alteraciones que en conjunto, definen la malignidad de un cáncer y generan los síntomas asociados a esta enfermedad.[11] Como ya se mencionó, SDC4 regula la migración de células en cultivo, de la misma forma, se ha estudiado el papel de SDC4 en la invasividad de algunos cánceres, en modelos en cultivo. En 2009, tres artículos reportaron la participación de SDC4 en la invasividad de células cancerosas;.[12] [13] [14] Utilizando distintas líneas celulares de melanoma, con distinto grado de invasividad, O’Connell y colaboradores, demostraron que existe una relación directa entre el nivel de expresión (transcrito y proteína) de SDC4 y el grado de invasividad. Es así como células con mayor invasividad en ensayos de matrigel, presentan una mayor expresión de SDC4. Se demostró también que la pérdida de función de SDC4 afecta la invasividad de dichas células.[15] Similares resultados se han encontrado para líneas celulares de cáncer cervical y cáncer hepático, en ambos casos, una pérdida de función de SDC4, genera una disminución en las propiedades invasivas de dichas células. SDC4 se convierte así, en un foco de atención importante para el estudio de la patogénesis del cáncer y se reafirma la idea de su esencial participación en la migración.
Función de SDC4 en el desarrollo de Xenopus laevis
Un proceso importante en el desarrollo embrionario es la gastrulación, etapa del desarrollo al final de la cual, se reordenan las tres capas germinales (endodermo, mesodermo y ectodermo), las cuales formarán todos los tejidos del embrión, tanto como sus ejes primarios. Este proceso involucra activos movimientos celulares, que corresponden a la epibolía, involución y la extensión y convergencia, este último, genera un alargamiento en el eje anteroposterior y un angostamiento en el eje mediolateral del embrión.[16]
En 2006, se identificó a SDC4 de Xenopus laevis (xSDC4), como un regulador de los movimientos morfogenéticos en el desarrollo embrionario en dicho modelo. Se demostró que tanto una ganancia, por microinyección de ARNm, como una pérdida de función de xSDC4, mediante Morfolinos (MOs), impiden los correctos movimientos de extensión y convergencia, generándose así embriones más cortos en el eje anteroposterior y que presentan defectos en el cierre de su tubo neural.[17] Un trabajo reciente, demostró además, mediante pérdida de función con MOs contra SDC4, que este proteoglicán es necesario para la correcta migración de las células de la cresta neural en el desarrollo de Xenopus laevis y Danio rerio.[18] Tales trabajos han definido nuevos ejemplos in vivo de que se requieren niveles precisos de SDC4, para la correcta migración celular, tal como sucede en células en cultivo, ahora en procesos de vital importancia en el desarrollo embrionario.
SDC4 como un regulador de la vía Wnt no canónica
Como ya se ha mencionado, los movimientos de extensión y convergencia durante la gastrulación en Xenopus laevis, son regulados por la vía de señalización Wnt. Se identificó al proteoglicán de heparán sulfato xSDC4 como un regulador de la vía de señalización Wnt no canónica, xSDC4 interactúa bioquímicamente con xDsh y con xFz7, elementos esenciales de esta vía de señalización.[19] En dicho trabajo se demostró que la sobreexpresión de xSDC4 en embriones, induce la traslocación de Dsh a la membrana, señal de activación de la vía Wnt no canónica, lo que es además dependiente de FN. La traslocación de Dsh, es totalmente inhibida por una pérdida de función de xSDC4, indicando que xSDC4 es necesario y suficiente para la función de esta vía en los embriones.[20] xSDC4 estimula la vía Wnt no canónica, río arriba de Dsh, ya que una pérdida de función de xSDC4, puede ser rescatada por la adición de DshΔDIX, un mutante de deleción de Dsh, que activa específicamente la vía Wnt no canónica.[21] Dicho trabajo situó a xSDC4, como un elemento que relaciona a la unión de la célula a la MEC, con la activación de la vía Wnt no canónica. Probablemente, dicha relación posee relevancia en los movimientos celulares necesarios, para la gastrulación de Xenopus laevis.
Función de SDC4 in vivo
Al observar la importante participación de SDC4 en la migración celular de células en cultivo, es válido hipotetizar sobre la posible participación de SDC4 en los muchos procesos que requieren migración celular en un organismo, tanto en su desarrollo embrionario, como en la vida adulta. Para poner a prueba dicha hipótesis, dos grupos, desarrollaron independiente ratones nulos para SDC4;.[22] [23] Ambos grupos mostraron que los ratones no poseen defectos macroscópicos ni a nivel reproductivo, desarrollándose normalmente. Hecho que probablemente responde a una función redundante de otros sindecanes. De forma interesante, un proceso que involucra migración celular, como es el cierre de una herida, ocurre de manera retrasada en los ratones nulos para SDC4, en comparación a los ratones silvestres, en ensayos de cierre de herida in vivo, mostrando que SDC4 es necesario para un proceso que in vivo, involucra migración celular.
Función de SDC4 en las células satélite del músculo
Se ha demostrado la presencia de Sindecán-4 en las células satélite y su influencia en la función de los progenitores musculares[24] se sabe que Sindecán-4 y 3 se expresan en las células satélite, incluso constituyéndose en un marcador específico de estas en el tejido muscular, Sindecán-4 se expresa durante todo el proceso de diferenciación de las células satélite asociado a su activación, lo que plantea la posibilidad de su participación en este proceso.[25] Trabajos posteriores identificaron la función de Sindecán-4 en la biología de las células satélite, es así como un ratón nulo para Sindecán-4 posee un menor número de células satélite que un ratón silvestre.[26] Una vez que las células satélite del ratón nulo para Sindecán-4 son activadas, estas muestran capacidades reducidas para migrar, para proliferar y son defectuosas en la expresión de MyoD.[27] Por otro lado, la sobreexpresión de Sindecán-4 en un modelo de células satélite, resulta también en una capacidad proliferativa disminuida y defectos en la diferenciación, función que es independiente de las cadenas de glicosaminoglicanes de Sindecán-4;.[28] [29]
Modificaciones postraduccionales de SDC4
- Fosforilación: Se ha descrito en células NIH3T3 que Sindecán-4 es fosforilado en la Ser 183 por una quinasa independiente de Calcio, dicha fosforilación regula la función de este proteoglicán, su oligomerización y unión a PIP2 y su unión a α-actinina, de esta manera, regulando negativamente su función en las adhesiones focales.[30]
- Ubiquitinación: Se ha demostrado que Sindecán-4 puede ser ubiquitinado, en su dominio citoplasmático, la ubiquitinación de Sindecán-4 regula su degradación en respuesta a ligandos Wnt no canónicos, sin embargo no regula la internalización de este proteoglicán.[31]
Interacciones
- SDC4 (Oligomerización)[32]
- Dishevelled[33]
- Frizzled 7[34]
- α-Actinina[35]
- Sintenina[36]
- Sindesmos[37]
- CASK[38]
- Sinactina[39]
- Ubiquitina[40]
- FGFR[41]
Referencias
- ↑ Woods A, Couchman JR (1994). «Syndecan 4 heparan sulfate proteoglycan is a selectively enriched and widespread focal adhesion component». Mol Biol Cell 5 (2).
- ↑ Woods A, Longley RL, Tumova S, Couchman JR (2000). «Syndecan-4 binding to the high affinity heparin-binding domain of fibronectin drives focal adhesion formation in fibroblasts». Arch Biochem Biophys 374 (1).
- ↑ Dovas A, Yoneda A, Couchman JR (2006). «PKCbeta-dependent activation of RhoA by syndecan-4 during focal adhesion formation». J Cell Sci 1 (13).
- ↑ Horowitz, a, M Murakami, Y Gao, and M Simons (1999). «Phosphatidylinositol-4,5-bisphosphate mediates the interaction of syndecan-4 with protein kinase C». Biochemistry 38 (48).
- ↑ Keum, Eunyoung, Yeonhee Kim, Jungyean Kim, Soojin Kwon, Yangmi Lim, Innoc Han, and Eok-Soo Oh (2004). «Syndecan-4 regulates localization, activity and stability of protein kinase C-alpha». The Biochemical journal 378 (3).
- ↑ Baciu, P C, and P F Goetinck (1995). «Protein kinase C regulates the recruitment of syndecan-4 into focal contacts». Molecular biology of the cell 6 (11).
- ↑ Saoncella S, Echtermeyer F, Denhez F, Nowlen JK, Mosher DF, Robinson SD, Hynes RO, Goetinck PF (1999). «Syndecan-4 signals cooperatively with integrins in a Rho-dependent manner in the assembly of focal adhesions and actin stress fibers». Proc Natl Acad Sci U S A 96 (6).
- ↑ Ananthakrishnan (2007). «The forces behind cell movement». Int J Biol Sci 3 (5).
- ↑ Woods A, Longley RL, Tumova S, Couchman JR (2000). «Syndecan-4 binding to the high affinity heparin-binding domain of fibronectin drives focal adhesion formation in fibroblasts». Arch Biochem Biophys 374 (1).
- ↑ Bass MD, Roach KA, Morgan MR, Mostafavi-Pour Z, Schoen T, Muramatsu T, Mayer U, Ballestrem C, Spatz JP, Humphries MJ (2007). «Syndecan-4-dependent Rac1 regulation determines directional migration in response to the extracellular matrix». J Cell Biol 7 (3).
- ↑ Hanahan D, Weinberg RA (2000). «The hallmarks of cancer». Cell 7 (1).
- ↑ Brule S, Friand V, Sutton A, Baleux F, Gattegno L, Charnaux N (2009). «Glycosaminoglycans and syndecan-4 are involved in SDF-1/CXCL12-mediated invasion of human epitheloid carcinoma HeLa cells». Biochim Biophys Acta 12 (1790).
- ↑ Charni F, Friand V, Haddad O, Hlawaty H, Martin L, Vassy R, Oudar O, Gattegno L, Charnaux N, Sutton A (2009). «Syndecan-1 and syndecan-4 are involved in RANTES/CCL5-induced migration and invasion of human hepatoma cells». Biochim Biophys Acta 10 (10).
- ↑ O'Connell MP, Fiori JL, Kershner EK, Frank BP, Indig FE, Taub DD, Hoek KS, Weeraratna AT (2009). «Heparan sulfate proteoglycan modulation of Wnt5A signal transduction in metastatic melanoma cells». J Biol Chem 284 (42).
- ↑ O'Connell MP, Fiori JL, Kershner EK, Frank BP, Indig FE, Taub DD, Hoek KS, Weeraratna AT (2009). «Heparan sulfate proteoglycan modulation of Wnt5A signal transduction in metastatic melanoma cells». J Biol Chem 284 (42).
- ↑ Keller R (2005). «Cell migration during gastrulation». Curr Opin Cell Biol 17 (5).
- ↑ Muñoz R, Moreno M, Oliva C, Orbenes C, Larraín J (2006). «Syndecan-4 regulates non-canonical Wnt signalling and is essential for convergent and extension movements in Xenopus embryos». Nat Cell Biol 8 (5).
- ↑ Matthews HK, Marchant L, Carmona-Fontaine C, Kuriyama S, Larraín J, Holt MR, Parsons M, Mayor R (2008). «Directional migration of neural crest cells in vivo is regulated by Syndecan-4/Rac1 and non-canonical Wnt signaling/RhoA». Development 135 (10).
- ↑ Muñoz R, Moreno M, Oliva C, Orbenes C, Larraín J (2006). «Syndecan-4 regulates non-canonical Wnt signalling and is essential for convergent and extension movements in Xenopus embryos». Nat Cell Biol 8 (5).
- ↑ Muñoz R, Moreno M, Oliva C, Orbenes C, Larraín J (2006). «Syndecan-4 regulates non-canonical Wnt signalling and is essential for convergent and extension movements in Xenopus embryos». Nat Cell Biol 8 (5).
- ↑ Muñoz R, Moreno M, Oliva C, Orbenes C, Larraín J (2006). «Syndecan-4 regulates non-canonical Wnt signalling and is essential for convergent and extension movements in Xenopus embryos». Nat Cell Biol 8 (5).
- ↑ Ishiguro K, Kadomatsu K, Kojima T, Muramatsu H, Tsuzuki S, Nakamura E, Kusugami K, Saito H, Muramatsu T (2000). «Syndecan-4 deficiency impairs focal adhesion formation only under restricted conditions». J Biol Chem 275 (8).
- ↑ Saoncella S, Echtermeyer F, Denhez F, Nowlen JK, Mosher DF, Robinson SD, Hynes RO, Goetinck PF (1999). «Syndecan-4 signals cooperatively with integrins in a Rho-dependent manner in the assembly of focal adhesions and actin stress fibers». Proc Natl Acad Sci U S A 96 (6).
- ↑ Cornelison DD, Filla MS, Stanley HM, Rapraeger AC, Olwin BB (2001). «Syndecan-3 and syndecan-4 specifically mark skeletal muscle satellite cells and are implicated in satellite cell maintenance and muscle regeneration». Dev Biol 239 (1).
- ↑ Cornelison DD, Filla MS, Stanley HM, Rapraeger AC, Olwin BB (2001). «Syndecan-3 and syndecan-4 specifically mark skeletal muscle satellite cells and are implicated in satellite cell maintenance and muscle regeneration». Dev Biol 239 (1).
- ↑ Cornelison DD, Wilcox-Adelman SA, Goetinck PF, Rauvala H, Rapraeger AC, Olwin BB (2004). «Essential and separable roles for Syndecan-3 and Syndecan-4 in skeletal muscle development and regeneration». Genes Dev 18 (18).
- ↑ Cornelison DD, Wilcox-Adelman SA, Goetinck PF, Rauvala H, Rapraeger AC, Olwin BB (2004). «Essential and separable roles for Syndecan-3 and Syndecan-4 in skeletal muscle development and regeneration». Genes Dev 18 (18).
- ↑ Velleman SG, Coy CS, McFarland DC (2007). «Effect of syndecan-1, syndecan-4, and glypican-1 on turkey muscle satellite cell proliferation, differentiation, and responsiveness to fibroblast growth factor 2». Poult Sci 86 (7).
- ↑ Zhang X, Nestor KE, McFarland DC, Velleman SG (2008). «The role of syndecan-4 and attached glycosaminoglycan chains on myogenic satellite cell growth». Matrix Biol 27 (7).
- ↑ Horowitz, a, and M Simons (1998). «Regulation of syndecan-4 phosphorylation in vivo». The Journal of biological chemistry 273 (18).
- ↑ Carvallo L, Muñoz R, Bustos F, Escobedo N, Carrasco H, Olivares G, Larraín J (2010). «Non-canonical Wnt signaling induces ubiquitination and degradation of Syndecan4». J Biol Chem 285 (38).
- ↑ Oh, E S, a Woods, and J R Couchman (1997). «Multimerization of the cytoplasmic domain of syndecan-4 is required for its ability to activate protein kinase C». The Journal of biological chemistry 272 (18).
- ↑ Muñoz R, Moreno M, Oliva C, Orbenes C, Larraín J (2006). «Syndecan-4 regulates non-canonical Wnt signalling and is essential for convergent and extension movements in Xenopus embryos». Nat Cell Biol 8 (5).
- ↑ Muñoz R, Moreno M, Oliva C, Orbenes C, Larraín J (2006). «Syndecan-4 regulates non-canonical Wnt signalling and is essential for convergent and extension movements in Xenopus embryos». Nat Cell Biol 8 (5).
- ↑ reene, Daniel K, Sarka Tumova, John R Couchman, and Anne Woods (2003). «Syndecan-4 associates with alpha-actinin». The Journal of biological chemistry 278 (9).
- ↑ Grootjans, J J, P Zimmermann, G Reekmans, a Smets, G Degeest, J Dürr, and G David (1997). «Syntenin, a PDZ protein that binds syndecan cytoplasmic domains». Proceedings of the National Academy of Sciences of the United States of America 94 (25).
- ↑ Couchman, J R, and a Woods (1999). «Syndecan-4 and integrins: combinatorial signaling in cell adhesion». Journal of cell science 112 (2).
- ↑ Couchman, J R, and a Woods (1999). «Syndecan-4 and integrins: combinatorial signaling in cell adhesion». Journal of cell science 112 (2).
- ↑ Couchman, J R, and a Woods (1999). «Syndecan-4 and integrins: combinatorial signaling in cell adhesion». Journal of cell science 112 (2).
- ↑ Carvallo L, Muñoz R, Bustos F, Escobedo N, Carrasco H, Olivares G, Larraín J (2010). «Non-canonical Wnt signaling induces ubiquitination and degradation of Syndecan4». J Biol Chem 285 (38).
- ↑ Wilcox-Adelman, Sarah a, Fabienne Denhez, Tokuro Iwabuchi, Stefania Saoncella, Enzo Calautti, and Paul F Goetinck (2003). «Syndecan-4: dispensable or indispensable?». Glycoconjugate journal 19 (4-5).
Wikimedia foundation. 2010.