- Vinculina
-
Vinculina HUGO 12665 Símbolo VCL Datos genéticos Locus Cr. 10 q22-23 Bases de datos Entrez 7414 OMIM 193065 RefSeq NM_014000 UniProt P18206 En las células de los mamíferos, la vinculina es una proteína de membrana-citoesqueleto ubicada en las placas de las adhesiones focales e involucrada en el anclaje de las moléculas de integrina al citoesqueleto de actina. En su secuencia es un 20-30% homóloga a la α-catenina, cuya función es similar.
Contenido
Estructura
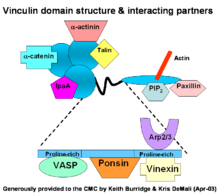
La vinculina es una proteína del citoesqueleto de unos 117 kDa y con una secuencia de unos 1066 aminoácidos. Contiene un extremo N-terminal ácido y uno C-terminal básico, separados por un segmento medio rico en prolina. Consiste en un dominio globular (cabeza) que contiene sitios de unión para tallina y α-actinina así como un sitio de fosforilación de tirosina, mientras que la región de la cola tiene sitios de unión para la actina F, paxilina y lípidos.
Conformación
El reciente descubrimiento de su estructura tridimensional da luz acerca de cómo la vinculina cambia su forma para cumplir con una variedad de funciones. Por ejemplo, la vinculina es capaz de controlar la movilidad celular simplemente alterando su forma de activa a inactiva. En su estado "inactivo", la conformación de la vinculina está caracterizada por la interacción entre sus dominios cabeza y cola. Al cambiar a su forma "activa",como cuando se une a la tallina, La interacción intramolecular entre la cabeza y la cola es interrumpida. En otras palabras, cuando los sitios de unión de tallina (VBS) de las α-helices, se unen a una estructura helicoidal en la cabeza de vinculina, la "conversión del paquete helicoidal" se inicia, lo cual conduce a la reorganización de las α-hélices (α1- α-4) resultando en un paquete de cinco hélices completamente nuevo. Esta función también se extiende a las células tumorales, regulando su movimiento y proliferación desde el sitio de inicio al resto del organismo.
Mecanismo y función
La difusión y movimiento celulares suceden mediante el proceso de unión entre los receptores de integrina de la superficie celular a las moléculas de adhesión de la matriz extracelular. La vinculina está asociada a las adhesiones focales y las uniones adherentes. El complejo de las adhesiones focales consiste en muchas proteínas como vinculina, α-actinina, paxilina, y tallina, en la cara citoplasmática de la membrana celular.
Más específicamente, el extremo amino-terminal de la vinculina se une a la tallina, la cual , al girar, se une a las β-integrinas, y el extremo carboxilo-terminal se une a la actina, fosfolípidos y paxilina formando homodímeros. La unión de la vinculina a la tallina y la actina está regulada por polifosfoinosítosidos e inhibida por fosfolípidos ácidos. Así, el complejo sirve para anclar los filamentos de actina a la membrana.
La pérdida de vinculina afecta una variedad de funciones celulares; altera la formación del complejo y evita la adhesión y difusión celulares. La ausencia de esta proteína demuestra una disminución de la difusión, acompañada por la reducción de la formación de fibras de tensión, formación de pocas adhesiones focales, e inhibición de la extensión de [[lamelipodia]. Se ha descubierto que las células deficientes en vinculina tienen conos de crecimiento que avanzan más lentamente, así como filopodias y lamelipodias menos estables. Basado en investigaciones, se ha postulado que la falta de vinculina podría disminuir la adhesión celular inhibiendo el ensamblaje de adhesiones focales y evitando la polimerización de la actina. Por otro lado, la sobreexpresión de vinculina podría restaurar la adhesión y difusión promoviendo el reclutamiento de proteínas del citoesqueleto al complejo de la adhesión focal en el sitio de unión a integrina. La habilidad de la vinculina para interactuar con integrinas al citosqueleto en las adhesiones focales parece ser indispensable para el control de la maquinaria del citoesqueleto, la difusión celular, y la formación de lamelipodia. De este modo, la vinculina juega un papel importante en el control de la forma basado en su habilidad de modular la estructura y función de las adhesiones focales.
Referencias
- Xu, W., Baribault, H., Adamson, E.D. (1998) Vinculin knockout results in heart and brain defects during embryonic development. Development. 125: 327-337.
- Ezzell RM, Goldmann WH, Wang N, Parasharama N, Ingber DE. (1997). Vinculin promotes cell spreading by mechanically coupling integrins to the cytoskeleton. Experimental Cell Research. 231(1):14-26.
- Goldmann, W.H., Ingber, D.E. (2001). Intact vinculin protein is Require for control of cell shape, cell mechanics, and rac-Dependent Lamellipodia Formation. Biochemical and Biophysical Research Communications. 290: 749-755.
- Ezzell RM, Goldmann WH, Wang N, Parasharama N, Ingber DE. (1997). Vinculin promotes cell spreading by mechanically coupling integrins to the cytoskeleton. Experimental Cell Research. 231(1):14-26.
- JR Feramisco, JE Smart, K Burridge, DM Helfman, and GP Thomas Co-existence of vinculin and a vinculin-like protein of higher molecular weight in smooth muscle J. Biol. Chem. 257: 11024-11031.
- Sebastian Witt, Anke Zieseniss, Ulrike Fock, Brigitte M. Jockusch, and Susanne Illenberger Comparative Biochemical Analysis Suggests That Vinculin and Metavinculin Cooperate in Muscular Adhesión Sites J. Biol. Chem. 279: 31533-31543.
- Strasser, P.; Gimona, M.; Herzog, M.; Geiger, B.; Small, J. V. : Variable and constant regions in the C-terminus of vinculin and metavinculin: cloning and expression of fragments in E. coli. FEBS Lett. 317: 189-194, 1993. PubMed ID : 8425604
- Belkin, A. M., Ornatsky, O. I., Glukhova, M. A., and Koteliansky, V. E. (1988) J. Cell Biol. 107, 545–553
Enlaces externos
Categorías:- Genes del cromosoma 10
- Citoesqueleto
Wikimedia foundation. 2010.