- Bicarbonato de sodio
-
mond
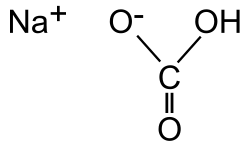

Nombre (IUPAC) sistemático Carbonato ácido de sodio General Otros nombres Bicarbonato de sodio
Hidrogenocarbonato de sodioFórmula semidesarrollada NaHCO3 Fórmula molecular n/d Identificadores Número CAS 144-55-8 Propiedades físicas Estado de agregación Sólido Apariencia blanco cristalino Densidad 2173 kg/m3; 2,173 g/cm3 Masa molar 84,0 g/mol Punto de fusión 323,15 K (50 °C) Punto de descomposición 543,15 K ( °C) Índice de refracción 1,3344 Propiedades químicas Solubilidad en agua 10,3 g/100 g de H2O Termoquímica ΔfH0sólido -951 kJ/mol S0sólido 102 J·mol-1·K-1 Riesgos HSci - Safety data Ingestión No peligroso excepto en cantidades muy grandes Inhalación Puede causar irritación Piel Puede causar irritación Ojos Puede causar ceguera LD50 4220 mg/kg Más información Hazardous Chemical Database (en inglés) Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl bicarbonato de sodio (también llamado bicarbonato sódico o hidrogenocarbonato de sodio o carbonato ácido de sodio) es un compuesto sólido cristalino de color blanco muy soluble en agua, con un ligero sabor alcalino parecido al del carbonato de sodio, de fórmula NaHCO3. Se puede encontrar como mineral en la naturaleza o se puede producir artificialmente.[1]
Cuando se expone a un ácido moderadamente fuerte se descompone en dióxido de carbono y agua. La reacción es la siguiente:
Debido a la capacidad del bicarbonato de sodio de liberar dióxido de carbono se usa junto con compuestos acídicos como aditivo leudante en panadería y en la producción de gaseosas. Algunas levaduras panarias contienen bicarbonato de sodio. Antiguamente se usaba como fuente de dióxido de carbono para la gaseosa Coca Cola.
Es el componente fundamental de los polvos extintores de incendios o polvo BC.
Contenido
Obtención
Mediante el proceso de Solvay. Aunque es utilizado para obtener Na2CO3, es posible obtener en una de las reacciones intermedias bicarbonato sódico. El proceso consiste en la siguiente reacción:
Na+ + Cl- + NH3 + H2O + CO2 → NaHCO3(s) + NH4+ + Cl-
En la cual precipita el bicarbonato de sodio.
Usos
El bicarbonato de sodio se usa principalmente en la repostería, donde reacciona con otros componentes para liberar CO2, que ayuda a la masa a elevarse, dándole sabor y volumen. Los compuestos ácidos que inducen esta reacción incluyen bitartrato de potasio (también conocido como crema de tártaro), jugo de limón, yogur, ácido acético.
Uso cultural y cosmético
El bicarbonato de sodio se utiliza como un agente alcalinizante que actúa en combinación a la saliva en el coqueo, de manera que se suaviza y se produce la extracción de los metabolitos de la hoja de coca haciéndose de esa manera el coqueo un proceso placentero y duradero en contraposición si no se usara el bicarbonato de sodio. El bicarbonato de sodio es a la coca lo que el azúcar al café, de manera que en la serranía del Perú y Bolivia (donde se practica el coqueo) el consumo de bicarbonato es alto.
En China se usa para lavarse los pies.
Se usa para combatir la acidez gástrica cuando no se dispone de medicamentos específicos (como el almagato). Sirve también para la limpieza por su poder abrasivo y desodorante (por ejemplo, para quitar el olor "a nuevo" de las neveras). Se usa además como blanqueador dental ya que pule la superficie del esmalte y como agente desodorante para eliminar olores de sudoración fuerte en axilas y pies.
Para los malestares estomacales podemos preparar una bebida caliente con hierbabuena, y una bebida fría con limón (limonada) y adicionarle una cucharadita de bicarbonato, mezclarlo bien y beberlo (recordando que no se debe endulzar). Una taza o vaso es suficiente para quitar la molestia....
Véase también
- Levadura
- Lista de minerales
- Carbonato de sodio
- Ácido carbónico
Referencias
Enlaces externos
 Wikcionario tiene definiciones para bicarbonato de sodio.Wikcionario
Wikcionario tiene definiciones para bicarbonato de sodio.Wikcionario Wikimedia Commons alberga contenido multimedia sobre Bicarbonato de sodio. Commons
Wikimedia Commons alberga contenido multimedia sobre Bicarbonato de sodio. Commons
Categorías:- Compuestos de sodio
- Bicarbonatos
- Código ATC B
- Antiácido
- Gasificantes
- Ingredientes culinarios
Wikimedia foundation. 2010.
