- Acetato de sodio
-
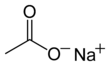
Acetato de sodio
Nombre (IUPAC) sistemático Acetato de sodio Etanoato de sodio
General Fórmula semidesarrollada CH3COONa NaC2H302 Fórmula molecular n/d Identificadores Número CAS 127-09-3 (Anhidrido) 6131-90-4 (Trihidratado)
Propiedades físicas Densidad 1450 kg/m3; 1,45 g/cm3 Masa molar n/d Punto de ebullición 610 K (337 °C) Propiedades químicas Valores en el SI y en condiciones normales
(0 °C y 1 atm), salvo que se indique lo contrario.
Exenciones y referenciasEl acetato de sodio, (también llamado, etanoato de sodio) es la sal de sodio del ácido acético. Es un producto químico económico producido en cantidades industriales para una amplia gama de uso.
Contenido
Aplicaciones acetato de sodio
El acetato de sodio es utilizado en la industria textil para neutralizar las corrientes residuales de ácido sulfúrico, y como fotorresistente cuando se usan colorantes de anilina. También se usa como agente de encurtido en el curtido con cromo, ayuda a retardar la vulcanización del cloropreno en la producción sintética de caucho.
Es el compuesto químico que da sabor a las patatas fritas. Se suele añadir a los alimentos como conservante; en este caso se nombra como diacetato de sodio y se etiqueta como E262.
Como base conjugada de un ácido débil, una disolución de acetato de sodio y ácido acético puede actuar como disolución tampón para mantener relativamente constante el pH. Esto es especialmente útil en bioquímica, donde las reacciones dependen del pH.
También se utiliza en las bolsas térmicas autoactivables ("hielo caliente"). Cuando se calientan cristales de acetato de sodio trihidratado (punto de fusión 58 °C)(se debe poner cristales hasta que no se pueda disolver mas) alrededor de 100 °C, estos se funden. Si se enfría tras este proceso, se obtiene una disolución supersaturada de acetato de sodio en agua. Esta disolución es capaz de enfriarse a temperatura ambiente, es decir, por debajo de su punto de fusión, sin formar cristales. Presionando en un disco metálico del interior de la bolsa, se forma un centro de nucleación que causa la cristalización de la disolución en acetato de sodio sólido.
Síntesis
El acetato de sodio es muy económico, y es comúnmente comprado a los distribuidores de productos químicos, en vez de ser sintetizado en el laboratorio. Es algunas veces producido en el laboratorio experimentalmente por la reacción del ácido acético con Carbonato de sodio, Bicarbonato de sodio, o Hidróxido de sodio para nombrar unas pocas bases que contienen Sodio.
CH3–COOH + Na+[HCO3] → CH3–COO– Na+ + H2O + CO2
Esta es una reacción conocida como "burbujeo" entre el Bicarbonato de sodio y el Vinagre. 84 gramos de Bicarbonato de sodio reaccionan con 750 g de vinagre con 8% de concentración de ácido acético para hacer 82 g de Acetato de sodio en solución. Por la posterior evaporación del agua, uno puede obtener una solución más o menos pura de Acetato de sodio o sus cristales.
También:
CH3-COOH + Na(OH). Para conseguir cantidades industriales. 100 g de Hidróxido de sodio (NaOH) reaccionan con 150 g de ácido acético puro (1875 g de vinagre al 8%), para dar 45 g de agua y 205 g de Acetato de sodio.
Reacciones
Una solución hiper-saturada de acetato de sodio en agua (disolviendo el acetato de sodio en agua caliente y posteriormente efriando la solución), cristaliza de forma rápida y es lo que comunmente se conoce como Hot Ice. El acetato de sodio no lo venden en farmacias, se debe sintetizar.
Galería
Enlaces externos
Categorías:- Compuestos de sodio
- Acetatos
- Productos químicos usados en fotografía
Wikimedia foundation. 2010.